露置于空气中一段时间后的水玻璃会变浑浊。向此浑浊溶液中加入稀盐酸,会生成白色沉淀,同时伴随有气泡产生。用化学方程式解释产生上述实验现象的原因:
(1)溶液变浑浊________________________________________。
(2)生成白色沉淀______________________________________。
(3)产生气泡__________________________________________。
(14分) 现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子Na+、Al3+、Mg2+、Ba2+、Fe3+和五种阴离子Cl-、OH-、NO、CO、X中的一种。
(1)某同学通过比较分析,认为无需检验就可判断其中必有的两种物质是 (填化学式)。
(2)为了确定X,现将(1)中的两种物质记为A和B。当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时产生棕灰色沉淀,向该沉淀中滴入稀HNO3沉淀部分溶解,最后留有白色沉淀不再溶解。则:
①X为 (填序号)。
A.SOB.SOC.CH3COO-D.SiO
②A中的化学键类型为 。
③B的水溶液中所有离子的浓度由大到小的顺序为 (用离子符号表示)。
④将0.02 mol的A与0.01 mol的C同时溶解在足量的蒸馏水中,充分反应后,最终所得沉淀的质量为
g(精确到0.1 g)。
⑤利用上述已经确定的物质,可以检验出D、E中的阳离子。请简述实验操作步骤、现象及结论 。
(3)将Cu投入到装有D溶液的试管中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,有关反应的离子方程式为 。
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)目前工业上有一种方法是用CO2来生产燃料甲 醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,在500oC下发生反应:
醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,在500oC下发生反应:
CO2(g)+3H2(g)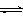 CH3OH(g)+H2O(g);△H=-49.0kJ/mol
CH3OH(g)+H2O(g);△H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。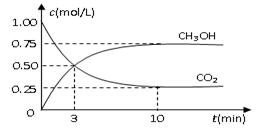
①从反应开始到平衡,氢气的平均反应速率
v(H2)=_________________________ _____;
_____;
②该反应的平衡常数K为__________ (精确到小数点后两位)。若提高温度到800oC进行达平衡时;K值__________,n(CH3OH)/n(CO2)比值__________(以上两空填“增大”、“减小”或“不变”);
(精确到小数点后两位)。若提高温度到800oC进行达平衡时;K值__________,n(CH3OH)/n(CO2)比值__________(以上两空填“增大”、“减小”或“不变”);
③平衡时CH3OH的体积分数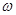 为__________;
为__________;
④若在相同条件下,起始时加入物质的量为:a mol CO2、b mol H2和c mol CH3OH、c mol H2O,达平衡后,CH3OH的体积分数仍为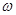 。则a、b、c的关系为__________。
。则a、b、c的关系为__________。
(2)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH―-4e―=O2↑+2H2O,则阴极反应式为_________ _____________________。
_____________________。
化学兴趣小组 对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。
I.摩擦剂中氢氧化铝的定性检验
取适量牙膏样品,加水充分搅拌、过滤。
(1)往滤渣中加入过量 NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是______________________________________ __________________________________________。
__________________________________________。
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察到的现象是_____________________________________ ______________________________________。
II.牙膏样品中碳酸钙的定量测定
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。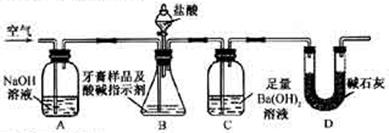
依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:______________________________________________________________________。
(4)D装置的作用是_______________________________________________ ___。
___。
(5)C中反应生成BaCO3的化学方程式是________________________________________。
(6)下列各项措施中,不能提高测定准确度的是__________(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(7)实验中准确称取8.00 g样品三份,进行三次测定,测得BaCO3平均质量为3.94 g。则样品中碳 酸钙的质量分数为__________。
酸钙的质量分数为__________。
(8)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是____________________________________________________________________。
I.由C、H、O三种元素组成的有机物A,A的相对分子质量不超过150,其中含碳元素的质量分数为68.9%,含氧元素的质量分数为26.2%。A与NaHCO3溶液反应,生成的气体能使澄清石灰水变浑浊。回答下列问题:
①A的分子式是____________________。
②A的一种同分异构体B,既能与NaOH溶液反应,又能与新制Cu(OH)2反应,且其苯环上的一氯 代物有两种。B的结构简式为_______________________________________。
代物有两种。B的结构简式为_______________________________________。
II.芳樟醇是贵重的香料,它可由多种方法合成。
(1)芳樟醇的一种工业合成路线如下: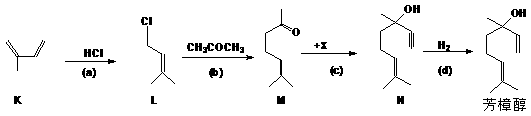
①上图中K的名称是:__________;(a)、(b)的反应类型分别是: 。
②已知c是加成反应,反应c中另一反应物X的结构式为:__________。
③L的同分异构体很多,其中只含一个甲基的链状同分异构体有__________种(不考虑顺反异构)。
④M中所含官能团的名称是:________________________________________。
⑤N的分子式是______________________________。
(2)芳樟醇的另一种常见合成路线如下:β一菠烯在600一700℃时可以开环生成月桂烯,月桂烯与HCl加成后再与CH3COONa反应转化为芳樟醇的乙酸酯,最后经水解得到芳樟醇。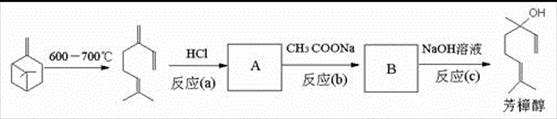
1.A的结构简式为:______________________________;
②反应(c)的化学方程式为:__________________________________ ________________。
________________。
下图所示各物质是由1~20号元素中部分元素组成的单质或其化合物,图中部分反应条件未列出。已知C、H是无色有刺激性气味的气体,D是一种黄绿色的气体单质,物质J可用于泳池消毒。反应②和④是化工生产中重要反应,反应⑤是实验室制备气体C的重要方法。
请回答下列问题:
(1)物质E的电子式是__________;I中所含化学键类型为:____________________;气体D所含元素在周期表中的位置是____________________。
(2)G的水溶液呈__________性,用离子方程式表示其原因___________________________。
(3)写出E与过量I溶液反应原离子方程式______________________________。
(4)写出实验室制备气体C反应的化学方程式______________________________,干燥气体C可选用__________做干燥剂(填名称)。
(5)写出反应④的化学方程式__________________________________________________。
(6)反应③的现象为______________________________。
(7)已知含7.4g I的稀溶液与200mL 1 mol/L的H溶液反应放出11.56kJ的热量,
写出该反应的热化学方程式________________________________________。
(8)物质A由三种元素组成,1 molA与水反应可生成1 mol B和2 mol C,A化学式为______________________________。