某溶液中可能含有H+、Na+、NH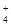 、Mg2+、Fe3+、Al3+、SO
、Mg2+、Fe3+、Al3+、SO 、CO
、CO 等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图像如图所示,下列说法正确的是( )
等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图像如图所示,下列说法正确的是( )
A.原溶液中含有的阳离子是H+、NH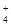 、Mg2+、Al3+ 、Mg2+、Al3+ |
B.原溶液中一定含有SO 和Na+ 和Na+ |
| C.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 |
| D.反应最后形成的溶液中所含溶质只有Na2SO4 |
配制一定体积、一定物质的量浓度的溶液时,下列操作会使配得的溶液浓度偏小的是
| A.容量瓶中原有少量蒸馏水 | B.溶液从烧杯转移到容量瓶中后没有洗涤烧杯 |
| C.定容时观察液面俯视 | D.滴管加水时,有少量水滴到容量瓶外 |
某化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2
连接好线路发现灯泡亮,由此得出的结论正确的是
| A. NaCl是非电解质 |
| B. NaCl溶液是电解质。 |
| C. NaCl在水溶液中电离出了可以自由移动的离子。 |
| D. NaCl溶液中水电离出大量的离子 |
用下图表示的一些物质或概念间的从属关系中不正确的是
| X |
Y |
Z |
|
| A. |
酸 |
化合物 |
纯净物 |
| B. |
电解质 |
盐 |
化合物 |
| C. |
胶体 |
分散系 |
物质 |
| D. |
碱性氧化物 |
氧化物 |
化 合物 合物 |
在无色溶液中,下列离子能大量共存的是
| A.Mg2+、SO42-、K +、Cl- | B.Na+、NH4+ 、NO3-、MnO4- |
| C.K +、Cu2+ 、Cl-、NO3- | D.Ba2+ 、Na+ 、OH-、HCO3- |
下列叙述正确的是
| A.1 mol H2O的质量为18g/mol | B.CO2的摩尔质量为44g |
| C.3.01×1023个SO2分子的质量为32g | D.标准状况下,1 mol任何物质体积均为22.4L |