将几滴KSCN(SCN-是“类卤离子”)溶液加入到含有Fe3+的酸性溶液中,溶液变成红色。将该红色溶液分为两份:①一份中加入适量KMnO4溶液,红色褪去;②向另一份中通入SO2,红色也褪去。下列推测肯定不正确的是( )
| A.①中红色褪去的原因是KMnO4将SCN- 氧化 |
| B.②中红色褪去的原因是SO2将Fe3+ 还原为Fe2+ |
| C.②中红色褪去的原因是SO2将SCN- 还原 |
| D.SCN-在适当条件下可失去电子被氧化为(SCN)2 |
下列实验过程中始终没有明显现象的是
| A.往AlCl3溶液中逐滴加入NaOH溶液 |
| B.往Fe(NO3)2溶液中逐滴加入稀H2SO4 |
| C.CO2通入饱和Na2CO3溶液中 |
| D.往Ba(OH)2溶液中逐滴加入稀HCl溶液 |
常温下用0.10 mol /L KOH溶液,滴定0.10 mol /L CH3COOH溶液,有关滴定过程中的说法正确的是
| A.滴定终点时:溶液的pH=7 |
B.滴定终点时:c(K+) = c(CH3COO- ),c(H+) < c(OH-) ),c(H+) < c(OH-) |
C.当溶液pH=7时:c(K+) =  c(CH3COO-) + c c(CH3COO-) + c (CH3COOH) (CH3COOH) |
| D.接近滴定终点时:c(K+) + c(H+) = c(CH3COO-) + c(OH-) |
能正确表示下列反应的离子方程式是
A.碳酸氢钠溶液中加入少量氢氧化钡:HCO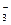 + Ba2+ + OH- ="=" BaCO3↓+ H2O + Ba2+ + OH- ="=" BaCO3↓+ H2O |
B.大理石跟稀盐酸反应:CaCO3 + 2H+ ="=" C a2+ + H2O+ CO2↑ a2+ + H2O+ CO2↑ |
| C.氢氧化镁跟稀硫酸反应:OH-+ H+ ="=" H2O |
D.碳酸氢铵溶液中加入足量氢氧化钠溶液:NH + OH- ="=" NH3·H2O + OH- ="=" NH3·H2O |
已知反应:2 E (l)  U (l) 。取等量的E,分别在20℃、50℃测得E的转化率随时间变化的关系曲线(Y-t)如右图所示。
U (l) 。取等量的E,分别在20℃、50℃测得E的转化率随时间变化的关系曲线(Y-t)如右图所示。
则下列说法正确的是
| A.该反应的∆H > 0 |
| B.b代表50℃下E的Y-t曲线 |
| C.m点(66,0.113)时有: ∆n (E,20℃) = ∆n (E,50℃) |
| D.升高温度可以缩短达到平衡的时间,提高E的转化率 |
下列实验不能达到预期目的是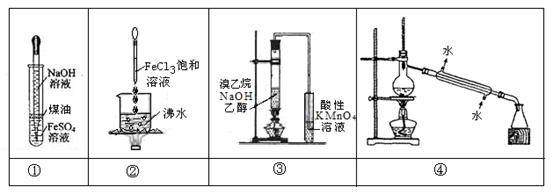
| A.实验①:挤出胶头滴管中的NaOH溶液,观察Fe(OH)2沉淀的颜色 |
| B.实验②:继续煮沸溶液至红褐色,停止加热,当光束通过体系时产生丁达尔效应 |
| C.实验③:通过观察酸性KMnO4溶液紫色褪去,确认有乙烯生成 |
| D.实验④:控制一定温度,将石油分离为汽油、柴油等 |