某混合溶液中可能含有的离子如下表所示:
| 可能大量含有的阳离子 |
H+、Ag+、Mg2+、Al3+、NH 、Fe3+ 、Fe3+ |
| 可能大量含有的阴离子 |
Cl-、Br-、I-、CO 、AlO 、AlO |
为探究其成分,进行了以下探究实验。
(1)探究一:
甲同学取一定量的混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如图所示。
①该溶液中一定含有的阳离子是______________,其对应物质的量浓度之比为________,一定不存在的阴离子是_____________;
②请写出沉淀减少过程中发生反应的离子方程式_____________________________。
(2)探究二:
乙同学检测到该溶液中含有大量的Cl-、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
| Cl2的体积(标准状况) |
5.6 L |
11.2 L |
22.4 L |
| n (Cl-) |
2.5 mol |
3.0 mol |
4.0 mol |
| n (Br-) |
3.0 mol |
2.8 mol |
1.8 mol |
| n (I-) |
x mol |
0 |
0 |
①当通入Cl2的体积为5.6 L时,溶液中发生反应的离子方程式为_______________;
②原溶液中Cl-、Br-、I-的物质的量浓度之比为______________________。
今有Fe和Zn的混合物12.1g,与足量的稀盐酸反应,共放出H2 4.48L(标准状况)。
求:(1)原混合物中Fe的质量分数。
(2)消耗HCl的物质的量。
将一定质量的Mg和Al混合物投入400 mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。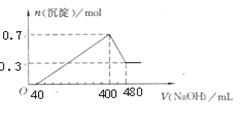
计算:
Mg和Al的总质量为__________g;硫酸的物质的量浓度为_________;生成的H2物质的量为________
为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液。下图是医院病人输液使用的一瓶质量分数为6%的葡萄糖(C6H12O6)注射液标签,
请认真观察标签上所列内容后计算:
(1)该溶液的物质的量浓度为mol·L-1。
(2)该溶液的密度为g·mL-1(精确到0.1g)。
(3)如果从该瓶中取出75g葡萄糖注射液,将其变为15%的注射液,需要加入 ______g葡萄糖固体(精确到0.1g)。
(本题共14分)
多硫化钙[ CaSx(x≤5)]、硫代硫酸钙组成的混合物称为石硫合剂,它是一种很好的植物杀虫剂,是由硫磺跟石灰、水等反应所得。不同比例的硫磺跟石灰在水溶液中反应,可生成不同的多硫化钙与硫代硫酸钙。
3Ca(OH)2+8S 2CaS3+CaS2O3+3H2O;3Ca(OH)2+6S
2CaS3+CaS2O3+3H2O;3Ca(OH)2+6S 2CaS2+CaS2O3+3H2O
2CaS2+CaS2O3+3H2O
完成下列计算:
52.硫磺溶解在硫化钠溶液中生成一种多硫化物,该多硫化物中硫元素的质量分数为0.736,则该Na2Sx中x =。
53.取某石硫合剂(假如只含两种含硫化合物)250mL(密度为1.12g/cm3)通入足量CO2使其快速分解。原理如下: Sx2—+2H2O+2CO2→(x—1)S↓+H2S↑+2HCO3—;S2O32—+ H2O+CO2→HSO3—+HCO3—+S↓完全反应后共收集到气体1.12升(标准状况)(忽略气体在溶液中的溶解),则该石硫合剂中多硫化钙的物质的量浓度为;硫代硫酸钙的质量分数为。(答案用小数表示,保留2位有效数字)
54.如果把生石灰、硫磺和水按质量比7∶16∶70的配比完全反应后,只生成两种含硫的化合物,则该石硫合剂中多硫化钙与硫代硫酸钙的物质的量之比是;多硫化钙的化学式是。
55.现有生石灰50.4g、硫磺96g、水504g恰好完全反应生成三种多硫化钙,除生成CaS4之外还有二种多硫化钙。请推算这二种多硫化钙可能的物质的量之比(写出推理过程)。
黄铜矿(主要成分CuFeS2)是提取铜的主要原料
已知:2CuFeS2+4O2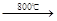 Cu2S+3SO2+2FeO炉渣产物Cu2S在1200℃高温下继续反应: 2Cu2S+3O2 → 2Cu2O+2SO2, 2Cu2O+Cu2S → 6Cu+SO2,假定各步反应都完全,完成下列计算:
Cu2S+3SO2+2FeO炉渣产物Cu2S在1200℃高温下继续反应: 2Cu2S+3O2 → 2Cu2O+2SO2, 2Cu2O+Cu2S → 6Cu+SO2,假定各步反应都完全,完成下列计算:
①由6 mol CuFeS2生成6 mol Cu,求消耗O2的物质的量mol
②6 mol CuFeS2和14.25 mol O2反应,理论上可得到mol铜