混合气体由N2和CH4组成,测得混合气体在标准状况下的密度为0.821g/L,则混合气体中N2和CH4的体积之比为
| A.1:1 | B.1:4 | C.4:1 | D.1:2 |
某烃W与溴的加成产物是2,2,3,3—四溴丁烷,与W互为同分异构体的是
| A.2—丁炔 | B.2—丁烯 | C.1,3—丁二烯 | D.1—丁炔 |
下列反应属于取代反应的是
A.C2H4+3O2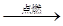 2CO2+2H2O 2CO2+2H2O |
B.Zn+CuSO4===ZnSO4+Cu |
| C.NaCl+AgNO3===AgCl↓+NaNO3 | D.CH4+Cl2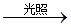 CH3Cl+HCl CH3Cl+HCl |
仔细分析下列表格中烃的排列规律,判断排列在第 15 位烃的分子式是
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
…… |
| C2H2 |
C2H4 |
C2H6 |
C3H4 |
C3H6 |
C3H8 |
C4H6 |
C4H8 |
C4H10 |
…… |
A.C6H12 B.C6H14 C.C7H12 D.C7H14
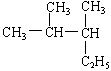 的名称是
的名称是
| A.2—甲基—3—乙基丁烷 | B.3,4—二甲基戊烷 |
| C.2,3—二甲基—4—乙基丙烷 | D.2,3—二甲基戊烷 |
下列说法正确的是
| A.35Cl和37Cl互称为同位素 |
B.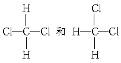 互称为同分异构体 互称为同分异构体 |
| C.H2、D2和T2互称为同素异形体 |
| D.C2H4与C4H8一定能互称为同系物 |