关于如图所示的原电池,下列说法正确的是( )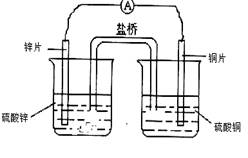
| A.盐桥中的阴离子向硫酸铜溶液中迁移 |
| B.锌电极发生还原反应,铜电极发生氧化反应 |
| C.铜电极上发生的电极反应是2H++e— →H2↑ |
| D.电子从锌电极通过检流计流向铜电极 |
用惰性电极电解一定量的硫酸铜溶液,实验装置如图①。电解过程中的实验数据如图②,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况)。则下列说法正确的是()
| A.电解过程中,b电极表面先有红色物质析出,后有气泡产牛 |
| B.a电极上发生的反应方程式为:2H++2e-一H2↑和4OH-—4e-==2H2O十O2↑ |
| C.曲线0~P段表示H2和O2混合气体的体积变化,曲线P~Q段表示O2的体积变化 |
| D.从开始到Q点时收集到的混合气体的平均摩尔质量为17g·mol-1 |
一定温度下,lmol X和n mol Y在锌积为2L的密闭容器中发生如下反应:
X(g)+Y(g) 2Z(g)+M(s),5min后达到平衡,此时生成2a mol Z。下列说法正确的是()
2Z(g)+M(s),5min后达到平衡,此时生成2a mol Z。下列说法正确的是()
| A.用X表示此反应的反应速率是(0.1—0.2a)mol·(L·min)-1 |
B.向l平衡后的体系中加入lmol M,平衡向逆反应 方向移动 方向移动 |
| C.当混合气体的质量不再发生变化时,说明反应达到平衡状态 |
| D.向上述平衡体系中再充入lmol X,v(正)增大,v(逆)减小,平衡正向移动 |
乙酸乙酯的制备实验中,得到乙酸乙酯、乙酸和乙醇的混合物。下列有关分离、提纯的方法可行的是()
| A.在混合物中继续加入浓硫酸、加热可得到纯净的乙酸乙酯 |
| B.先加入氢氧化钠浓溶液,再进行蒸馏可得到乙酸乙酯 |
| C.先加入饱和碳酸钠溶液,再进行分液可得到乙酸乙酯 |
| D.分离出乙酸乙酯后的混合液,可继续用分液漏斗分离乙酸和乙醇 |
已知X、Y、Z、W是四种短周期非金属元素,在周期表中的相对位置如下图所示,下列说法不正确的是()
| A.Z元素的最高化合价可能比Y元素的高 |
| B.X、Y、Z、W的氢化物中,X的氢化物沸点可能最低 |
| C.Z的单质为原子晶体时,W的单质可能为分子晶体 |
| D.X的最高价氧化物对应水化物与其氢化物不可能相互反应 |
下列说法正确的是()
| A.pH=2和pH=l的硝酸中c(H+)之比为10:1 |
| B.一元酸与一元碱恰好完全反应后的溶液中一定存在c(H+)=c(OH-) |
| C.KAl(SO4)2溶液中离子浓度的大小顺序为c(SO2-4)>c(K+)>c(Al3+)>c(H+)>c(OH-) |
| D.常温下,将pH均为12的氨水和NaOH溶液分别加水稀释100倍后,NaOH溶液的pH较大 |