如图是2004年批量生产的笔记本电脑所用的甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子。电子经外电路、质子经内电路到达另一极与氧气反应。
电池总反应式为 2CH3OH+3O2=2CO2+4H2O。下列说法中正确的是 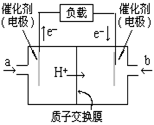
| A.右边的电极为电池的负极,b处通入的是空气 |
| B.左边的电极为电池的负极,a处通入的是甲醇 |
| C.电池负极的反应式为:CH3OH+H2O-6e-=CO2+6H+ |
| D.电池的正极反应式为:O2+2H2O+4e-=4OH- |
已知3.6 g碳在6.4 g氧气中燃烧,至反应物耗尽,测得放出热量a kJ。又知12.0 g碳完全燃烧,放出热量为 b kJ。则热化学方程式C(s)+1/2O2(g)=CO(g) ΔH=Q中Q等于
| A.-(a-b) kJ·mol-1 | B.-(a+b) kJ·mol-1 |
| C.-(5a-0.5b) kJ·mol-1 | D.-(10a-b) kJ·mol-1 |
已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1
Na2O2(s)+CO2(g)=Na2CO3(s)+ O2(g)ΔH=-266 kJ·mol-1
O2(g)ΔH=-266 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是
| A.CO的燃烧热为283 kJ |
B.如图可表示由CO生成CO2的反应过程和能量关系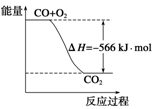 |
| C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)ΔH>-532kJ/mol |
| D.CO(g)与Na2O2(s)反应放出549 kJ热量时,电子转移数为6.02×1023 |
天然维生素P(结构如下图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是 
| A.可与溴水反应,且1 mol该物质与足量溴水反应消耗6 mol Br2 |
| B.可与NaOH溶液反应,1 mol该物质可与5 mol NaOH反应 |
| C.一定条件下1 mol该物质可与H2加成,耗H2最大量为6 mol |
| D.维生素P能发生水解反应 |
某有机物(X)的结构简式如下图,下列关于它的说法不正确的是
| A.X遇FeCl3溶液能发生显色反应 |
| B.一定条件下,X能发生取代、水解、氧化、加成、加聚、缩聚等反应 |
| C.1mol X分别与足量的NaOH、氢气反应,最多能消耗5mol NaOH 、7mol 氢气 |
| D.与等量X反应时,所需Na、NaHCO3、Na2CO3的最大量物质的量之比是3:1:1.5 |
下列条件下,两瓶气体所含原子数一定相等的是
| A.同质量的C2H4和CO |
| B.同体积、同密度的C2H4和C3H6 |
| C.同温度、同体积的H2和N2 |
| D.同压强、同体积的N2O和CO2 |