下列说法正确的是( )
| A.原子最外层电子数等于或大于3(小于8)的元素一定是非金属元素 |
| B.原子最外层只有1个电子的元素一定是金属元素 |
| C.最外层电子数比次外层电子数多的元素一定位于第二周期 |
| D.某元素的离子最外层电子数与次外层电子数相同,该元素一定位于第三周期 |
已知反应:
①25℃、101kP a时:N2H4(g)+O2(g)=N2(g)+2H2O(g);△H =-534 kJ·mol-1
a时:N2H4(g)+O2(g)=N2(g)+2H2O(g);△H =-534 kJ·mol-1
②稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3 kJ·mol-1
下列结论正确的是()
| A.N2H4的燃烧热大于534 kJ·mol-1 |
| B.①的反应热为221 kJ·mol-1 |
| C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ·mol-1 |
| D.稀醋酸与稀NaOH溶液反应生成l mol水,放出57.3 kJ热量 |
下列各组热化学方程式中Q1大于Q2(Q1、Q2为正值)的有()
①HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l);△H=-Q1kJ·mol-1
HAc(aq)+KOH(aq)=HAc(aq)+H2O;△H=-Q2kJ·mol-1
②C(s)+ O2(g)=CO(g);△H=-Q1kJ·mol-1
O2(g)=CO(g);△H=-Q1kJ·mol-1
C(s)+O2(g)=CO2(g);△H=-Q2kJ·mol-1
③4Al(s)+3O2(g)=2Al2O3(s);△H=-Q1kJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s);△H=-Q2kJ·mol-1
④H2(g)+ O2(g)=H2O(g);△H=-Q1kJ·mol-1
O2(g)=H2O(g);△H=-Q1kJ·mol-1
H2(g)+ O2(g)=H2O(l);△H=-Q2kJ·mol-1
O2(g)=H2O(l);△H=-Q2kJ·mol-1
| A.①② | B.③④ | C.②④ | D.①③ |
下列反应的离子方程式正确的是()
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体: |
| B.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O |
C.实验室用浓盐酸与MnO2反应制Cl2: |
| D.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+ |
已知pH=1的某溶液中存在较多的Ba2+、NO3-,则该溶液中还可能大量存在的离子组是()
| A.Fe3+、F-、Cl- | B.Mg2+、SO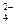 、Br- 、Br- |
| C.Mg2+、Cl-、Fe2+ | D.Na+、NH 、Cu2+ 、Cu2+ |
锰的氧化物MnO2、Mn2O3、Mn3O4,Mn2O7在加热时均能和浓盐酸反应生成MnCl2和Cl2。现11.45 g锰的某种氧化物跟足量的盐酸反应,产生的氯气在标准状况下的体积为1.12 L,则参加反应的氧化物是( )
| A.MnO2 | B.Mn2O3 | C.Mn3O4 | D.Mn2O7 |