A、B、C、D 4种元素的核电荷数依次增加,他们的离子电子层数相同且最外层电子数均为8。A原子的L层电子数与K、M层电子数之和相等,D原子的K、L层电子数之和等于电子总数的一半。回答下列问题:
(1)这4种元素的符号依次是A _____ ,B _____ ,
C _____ ,D _____ 。它们的原子半径由大到小的顺序是_________________ 。
(2)分别写出这4种元素的最高价氧化物对应水化物的化学式:_________________ ,
分别比较酸性和碱性的强弱: _________________ 。
(3)写出气态氢化物的化学式: _______________ 。比较其稳定性:______________,理由是_________ 。
硫酸在日常生产生活中应用非常广泛。请回答硫酸工业中的如下问题:
(1)早期生产硫酸以黄铁矿为原料,目前很多国家都已经限制以黄铁矿为原料而以硫黄为原料,以硫黄为原料的优点是。
(2)工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3,是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO27%;O21l%;N2 82%);
| 压强/Mpa 转化率/% 温度/℃ |
0.1 |
0.5 |
1 |
10 |
| 400 |
99.2 |
99.6 |
99.7 |
99.9 |
| 500 |
93.5 |
96.9 |
97.8 |
99.3 |
| 600 |
73.7 |
85.8 |
89.5 |
96.4 |
利用表中数据分析。在实际生产中选择的适宜生产条件是:温度______ ℃,压强 ___________MPa。
(3)选择适宜的催化剂,是否可以提高SO2的转化率? _______(填“是”或“否”),是否可以增大该反应所放出的热量?(填“是” 或“否”)。
(4)为提高SO3吸收率,实际生产中用吸收SO3。
(5)在催化反应室中设有热交换装置,以下叙述与热交换装置的作用有关的是______(填写序号)。
| A.保护环境。防止空气污染 | B.充分利用热量,降低生产成本 |
| C.升高温度,提高SO2的转化率 | D.防止催化剂中毒 |
(6)在硫酸工业尾气中,SO2是主要大气污染物,必须进行净化处理,处理方法可用________(填名称)吸收,然后再用硫酸处理,重新生成SO2和一种生产水泥的辅料,写出这两步反应的化学方程式_______________________________________。
Ⅰ、某化学活动小组利用如下甲装置对原电池进行研究,请回答下列问题:(其中盐桥为含有饱和KCl溶液的琼脂)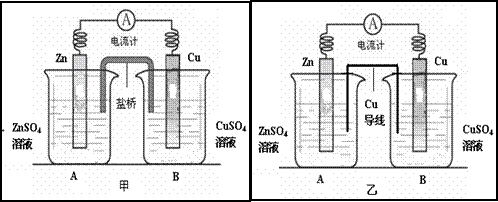
(1)在甲图装置中,当电流计中指针发生偏转时,盐桥中的离子移动方向为:K+移向_____烧杯,Cl-移向______烧杯(填“A”或“B”),装置中电子的移动路径和方向为___________________________
Ⅱ、该小组同学提出设想:如果将实验中的盐桥换为导线(铜制),电流表是否也发生偏转呢?带着疑问,该小组利用图乙装置进行了实验,发现电流计指针同样发生偏转。回答下列问题:
(2)该小组的一位成员认为溶液中的阴阳离子能通过铜导线从而构成闭合回路形成电流,该装置仍然为原电池。你对该观点的评 价是__________(填“正确”或“不正确”)
价是__________(填“正确”或“不正确”)
(3)对于实验中产生电流的原因,该小组进了深入探讨,后经老师提醒注意到使用的是铜导线,烧杯A实际为原电池。那么在烧杯B中铜片上发生反应的电极反应式为______________________
(4)对于图乙烧杯A实际是原电池的问题上,该小组成员发生了很大分歧:
①一部分同学认为是由于ZnSO4溶液水解显酸性,此时原电池实际是由Zn、Cu做电极,H2SO4溶液作为电解质溶液而构成的原电池。如果这个观点正确,那么原电池的电极反应式为:正极:_________________________________
②另一部分同学认为是溶液酸性较弱,由于溶解在溶液中的氧气的作用,使得Zn、Cu之间形成原电池。如果这个观点正确,那么原电池的电极反应式为:
正极:_________________________________
(5)若第(4)问中②观点正确,则可以利用此原理设 计电池为在偏远海岛工作的灯塔供电。其具体装置为以金属铝和石墨为电极,以海水为电解质溶液,请写出该电池工作时总反应的化学方程式____________________________________
计电池为在偏远海岛工作的灯塔供电。其具体装置为以金属铝和石墨为电极,以海水为电解质溶液,请写出该电池工作时总反应的化学方程式____________________________________
下图中所有物质均为中学化学常见物质,F、H是气体单质,Z是金属单质,Y中阳离子与阴离子个数比为2 :1,化合物X、Y、A、D、E、G的焰色反应均为黄色,I是白色胶状沉淀。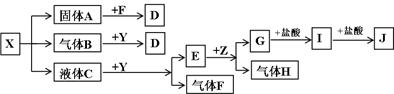
请回答下列问题:
(1)Y的电子式。关于Y的说法正确的是
A.Y是酸性氧化物 B.Y是过氧化物
C.Y是碱性氧化物 D.Y可以作漂白剂
(2)J溶液中离子浓度由大到小的顺序为__________________________________
(3)写出G与盐酸反应生成I的离子方程式
(4)写出B与Y反应的化学方程式
(5)将一定量的黄绿色气体W2通入到E的溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含W元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化如图所示。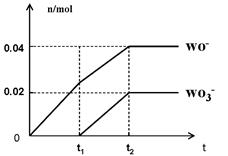
该反应中转移电子的物质的量是mol,该反应总反应的化学方程式为。
(16分)肉桂酸甲酯(H)是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。它的分子式为C10H10O2,且分子中只含有1个苯环,苯环上只有一个取代基。
又知J为肉桂酸甲酯的一种同分异构体,其分子结构模型如下图所示(图中球与球之间连线表示单键或双键)。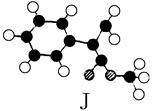
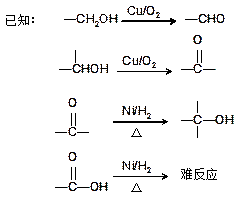
试回答下列问题。
(1)①肉桂酸甲酯(H)的结构简式为。
②有关肉桂酸甲酯的叙述中,正确的是(填标号)。
| A.能与溴的四氯化碳溶液发生加成反应 | B.不能使酸性高锰酸钾溶液褪色 |
| C.在碱性条件下能发生水解反应 | D.不可能发生加聚反应 |
(2)现测出A的核磁共振氢谱谱图有6个峰,其面积之比为1﹕2﹕2﹕2﹕1﹕2。
用芳香烃A 为原料合成H的路线如下: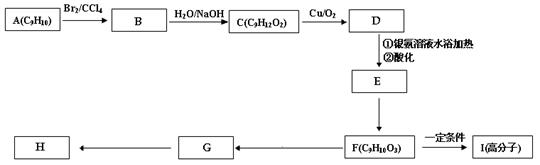
2化合物F中的官能团有(填名称)。
4B→C的反应类型是,F→G的反应类型是。
5书写化学方程式
F→I
G→H
(3)写出符合下列条件的G的同分异构体的结构简式:
ⅰ.分子内含苯环,且苯环上只有一个支链;
ⅱ.一定条件下,1mol该物质与足量的银氨溶液充分反应,生成4mol银单质。
最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。“绿色自由”构想技术流程如下: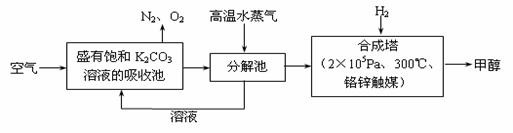
(1)在合成塔中,若有2.2kgCO2与足量H2恰好完全反应,生成气态的水和甲醇,可放出2473.5kJ的热量,试写出合成塔中发生反应的热化学方程式。
(2)①上述合成反应具有一定的可逆性,从平衡移动原理分析,低温有利于原料气的转化,而实际生产中采用300°C的温度,其原因是。
②“绿色自由”构想技术流程中常包括物质和能量的“循环利用”,上述流程中能体现“循环利用”的除碳酸钾溶液外,还包括。
③下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1mol CO2和3mol H2 |
(3)甲醇可制作燃料电池。写出以氢氧化钾为电解质的甲醇燃料电池负极反应式。当电子转移的物质的量为时,参加反应的氧气的体积是6.72L(标准状况下)。
(4)常温下,0.1 mol/L KHCO3溶液的pH大于8,则溶液中各种离子浓度由大到小的顺序为:
。