(14)下表为元素周期表的一部分,列出了10种元素在元素周期表中的位置。试回答下列问题:
| ① |
|
|
|||||||||||||||
| |
|
|
|
⑥ |
|
⑦ |
|
|
|||||||||
| ② |
④ |
⑤ |
|
|
|
⑧ |
|
||||||||||
| ③ |
|
|
|
|
|
|
⑩ |
|
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
⑨ |
|
⑴②、③、④三种元素最高价氧化物的水化物的碱性由强到弱的顺序是 (填化学式)。
⑵10种元素中,原子半径最小的是 (填序号)。
⑶元素⑦的氢化物分别与②和⑧的单质反应的离子方程式为 ,
。
⑷元素②和⑤的最高价氧化物的水化物相互反应的化学方程式为 。
⑸元素⑩的原子序数为 ,该元素在地壳中的含量居第四位,是目前应用最广泛的一种金属,其单质与⑧的氢化物的水溶液反应的离子方程式为 。
⑹⑥与⑧形成化合物的化学式为 ;单质⑨溶于该化合物所得溶液呈 色。
氯碱厂电解饱和食盐水制取NaOH溶液的工艺流程示意图如下所示,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上电极反应为__________________,与电源负极相连的电极附近,溶液pH_________(选填“不变”、“升高”或“下降”)。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为_________
_______________________________________________________________。
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂不能是_________。
a. Ba(OH)2 b. Ba(NO3)2c. B aCl2
aCl2
(4)为了有效除去Ca2+、Mg2+、SO42-,加入试剂不合理的顺序为_______(选填a、b、c)
a. 先加 NaOH,后加Na2CO3,再加钡试剂
NaOH,后加Na2CO3,再加钡试剂
b. 先加NaOH,后加钡试剂,再加Na2CO3
c. 先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过_________、冷却、_________(填写操作名称)除去NaCl。
有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且 都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级
都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级 电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)A是________,B是________,C是________,D是________,E是_________。
(2)由 这五种元素组成的一种化合物是(写化学式)________________________。写出该物质的一种
这五种元素组成的一种化合物是(写化学式)________________________。写出该物质的一种
主要用途。______________________________。
(3)写出C元素基态原子的电子排布式_________________________。
(4)用轨道表示式表示D元素原子的价电子构型____________________。
如图为以惰性电极进行电解:
(1)写出B、C、D各电极上的电极反应式和总反应方程式:
A:________________________________,B:________________________________,
总反应方程式:________________________;
C:________________________________, D:________________________________,
总反应方程式:_________ ___________
___________ _______;
_______;
(2)在A、B、C、D各电极上析出生成物的物质的量比为__________________。
已知某元素原子的电子排布 式是1s22s22p63s23p63d104s24p1。
式是1s22s22p63s23p63d104s24p1。
(1)该元素的原子序数为。
(2)该元素位于第周期族。
(3)该原子的电子总数为,价电子 总数为。
总数为。
A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品。A能发生如图所示的变化。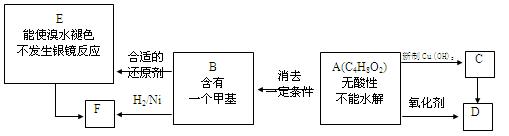
试回答:
(1)写出符合下述条件A的同分异构体的结构简式(各任写一种):
a.具有酸性,H-NMR谱图有3组峰________;
b.能发生水解反应,H-NMR谱图有4组峰_________。
(2)A分子中含氧官能团的名称是 ,D结构简式是 。
(3)写出化学方程式:A→B 。
(4)写出E生成高聚物的化学方程式: 。
(5)C的同分异构体C1与C有相同的官能团,两分子C1脱去两分子水形成含有六元环的C2,写出C1的结构简式(有几种写几种): 。