右图所示为8000C时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( ) 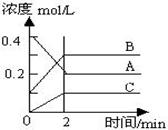
A.A是反应物
B.前2 min A的分解速率为0.1mol•L-1•min-1
C.达平衡后,若升高温度,平衡向正反应方向移动
D.达平衡后,若增大压强,平衡向逆反应方向移动
1体积某气态烃和2体积氯化氢发生加成反应后,最多还能和6体积氯气发生取代反应。由此可以断定原气态烃是(气体体积均在相同条件下测定()
| A.乙炔 | B.丙炔 | C.丁炔 | D.丁二烯 |
硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下,下列说法正确的是()
| A.温度一定时,Ksp(SrSO4)随c(SO42-)的增大而减小 |
| B.三个不同温度中,363K时Ksp(SrSO4)最大 |
| C.283K时,图中a点对应的溶液是不饱和溶液 |
| D.283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液 |
关于铜电极的叙述中不正确的是()
| A.铜锌原电池中铜是正极 |
| B.在镀件上镀铜时可用金属铜作阳极 |
| C.用电解法精炼铜时粗铜做阳极 |
| D.用电解法精炼铜时纯铜做阳极 |
下列事实不能用勒夏特列原理解释的是()
| A.浓度均为0.1 mol / L的新制氯水,加入少量NaHSO3晶体,片刻后,溶液中HClO 分子的浓度减小 |
| B.室温下,将1 mL pH=3的醋酸溶液加水稀释至100 mL后,测得其pH<5 |
| C.在硫化氢水溶液中加入碱有利于S2—的生成 |
| D.500℃左右比室温更利于合成氨反应 |
下列叙述正确的是()
| A.1.00mol NaCl中含有6.02×1023个NaCl分子 |
| B.1.00mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023 |
| C.欲配制1.00L ,1.00mol/L的NaCl溶液,可将58.5g NaCl溶于1.00L水中 |
| D.电解58.5g 熔融的NaCl,能产生22.4L氯气(标准状况)、23.0g金属钠 |