常温下,将等浓度的FeSO4和(NH4) 2SO4两种浓溶液混合可制得一种晶体,该晶体是分析化学中常用的一种还原剂,其强热分解反应化学方程式:2(NH4)2Fe(SO4)2·6H2O Fe2O3+2NH3↑+N2↑+4SO2↑+17H2O,下列说法正确的是
Fe2O3+2NH3↑+N2↑+4SO2↑+17H2O,下列说法正确的是
| A.1 mol摩尔盐强热分解时转移电子的物质的量为8NA |
| B.该反应中氧化产物是N2、NH3,还原产物是SO2、Fe2O3 |
| C.向摩尔盐溶液中滴入足量浓NaOH溶液,最终可得刺激性气体和白色沉淀 |
| D.常温下,摩尔盐的溶解度比FeSO4、(NH4)2SO4小 |
乙醇(CH3CH2OH)和二甲醚(CH3—O—CH3)互为()的同分异构体,
| A.位置异构 | B.官能团异构 | C.手性异构 | D.碳链异构 |
乙炔和乙烯的混合气体在标况下体积为22.4L,点燃并完全燃烧,生成27g的液态水,则乙炔和乙烯的体积比
| A.1:1 | B.1:2 | C.2:3 | D.3:2 |
关于炔烃的下列描述正确的是()
| A.通式为CnH2n-2的不饱和烃是炔烃 |
| B.炔烃分子里的所有碳原子都在同一直线上 |
| C.炔烃易发生加成反应,也易发生取代反应 |
| D.炔烃可以使溴水褪色,也可以使酸性高锰酸钾溶液褪色 |
某烃的分子式为C10H14,不能使溴水褪色,但可使酸性KMnO4溶液褪色,分子结构中只含一个烷基,则此烷基的结构有( )
| A.2种 | B.3种 | C.4种 | D.5种 |
下列各化合物的命名中正确的是()
| A.CH2=CH-CH=CH21,3—二丁烯 |
B. 对二甲苯 对二甲苯 |
C.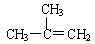 2—甲基—2—丙烯 2—甲基—2—丙烯 |
D.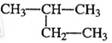 2-乙基丙烷 2-乙基丙烷 |