NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.在0.2 mol·L-1的Na2CO3溶液中含有Na+的数目为0.4NA |
| B.0.1 mol Fe参加氧化还原反应,转移的电子数目一定是0.3NA |
| C.15.6 g Na2O2与过量CO2反应时,转移的电子数为0.4NA |
| D.标准状况下22.4 L CH4和C2H4的混合气体所含氢原子数为4NA |
下列有关溶液的存储和配置的描述错误的是
| A.新制的氯水可盛放在棕色细口瓶中 |
| B.水玻璃可存放在橡胶塞的细口瓶中 |
| C.配置FeCl3溶液,先加浓盐酸溶液溶解氯化铁固体,再稀释至相应浓度 |
| D.称取2.5g硫酸铜晶体,加100ml水溶液配制0.1mol.L—1硫酸铜溶液 |
下列涉及化学概念和进本原理说法正确的是
| A.12C14C C60互为同分异构体 |
| B.由同种元素组成的物质一定是纯净物 |
| C.金属氧化物存在酸性氧化物 |
| D.N2O3的水溶液能导电,说明N2O3是电解质 |
下列与摩尔盐[(NH4)2Fe(SO4)2.6H2O溶液有关离子方程式错误的是
| A.通入足量的溴水:2Fe2++Br2=2Fe3++2Br- |
| B.先加盐酸在通入BaCl2溶液:SO42-+Ba2+=BaSO4↓ |
| C.加氢氧化钠固体加热:NH4++OH-=NH3↑+H2O |
| D.检验该溶液是否变质:Fe3++3SCN-=Fe(SCN)3 |
化学反应条件(浓度、温度、加入实际量或顺序等)的变化会影响化学反应结果。下列对产生不同化学反应结果的影响因素分析错误的是
| 选项 |
反应物质 |
反应结果 |
影响因素 |
| A |
Na O2 |
Na2O Na2O2 |
反应温度 |
| B |
Cu HNO3 |
NO NO2 |
铜的还原性 |
| C |
Na2S溶液 SO2 |
澄清或者浑浊 |
SO2通入量 |
| D |
AgNO3 NH3.H2O |
澄清或者浑浊 |
试剂加入顺序 |
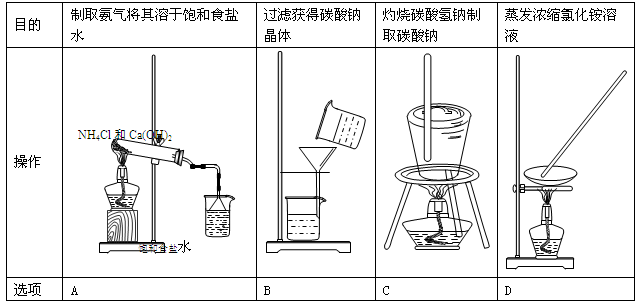
实验师模拟侯氏制碱法制取纯碱和氯化铵溶液,有关操作错误的是