由短周期元素组成的甲、乙、丙、丁四种物质分别含有两种或两种以上元素,它们分子中质子总数均与氩原子的质子数相同,已知甲是气态氢化物,在水中分步电离出两种阴离子。下列推断合理的是:
| A.某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应 |
| B.乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键 |
| C.丙中含有第2周期IV A族的元素,则丙一定是甲烷的同系物 |
| D.丁和甲含有相同元素,且该元素在二者中的百分含量相同,则丁中一定含有-l价元素 |
将pH=13的NaOH溶液平均分成两份,一份加适量水,另一份加入与该NaOH溶液物质的量浓度相同的适量硫酸后,pH都降低了1,则加入的水与硫酸的体积比为( )
| A.10:1 | B.11:1 | C.20:1 | D.21:1 |
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如下图所示。下列叙述中正
确的是 ( )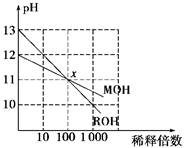
| A.在x点时,ROH完全电离 |
| B.在x点时,c(M+)>c(R+) |
| C.MOH是一种强碱 |
| D.稀释前,c(ROH)=10c(MOH) |
常温下,向等物质的量浓度的两种一元酸的盐溶液中,分别通入少量的CO2,发生如下反应:NaA+CO2+H2O===HA+NaHCO3 2NaB+CO2+H2O===2HB+Na2CO3,则等物质的量浓度的HA和HB在水中电离出H+的能力大小关系是 ( )
| A.HA较强 | B.HB较强 | C.两者一样 | D.无法比较 |
在0.1mol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH  CH3COO-+H+ 对于该平衡,下列叙述正确的是( )
CH3COO-+H+ 对于该平衡,下列叙述正确的是( )
| A.加入少量NaOH固体,平衡向逆反应方向移动 |
| B.升高温度,平衡向正反应方向移动 |
| C.加入水,CH3COOH的电离程度变大,溶液中c(H+)一定增大 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |
下列有关化学反应速率的说法中,正确的是 ( )
| A.100 mL 2 mol/L的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 |
| B.用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率 |
| C.二氧化硫的催化氧化是一个放热反应,所以升高温度,反应速率减慢 |
| D.汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢 |