工业上采用的一种污水处理方法是:保持污水的pH在5.0-6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。某科研小组用此法处理污水,设计装置示意图,如图所示。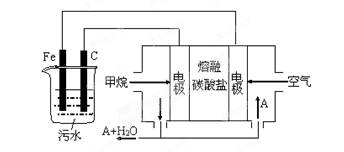
⑴实验时若污水中离子浓度较小,导电能力较差,无法使悬浮物形成浮渣。此时,应向污水中加入适量的__________。
a.BaSO4 b.CH3CH2OH c.Na2SO4 d.NaOH
⑵电解池阳极发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是:
Ⅰ._____________________________;Ⅱ.______________________________。
⑶电极反应Ⅰ和Ⅱ的生成物反应得到Fe(OH)3沉淀的离子方程式是____________________。
⑷该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图)。A物质的化学式是_________________;
多数元素的原子不能稳定存在,形成化学键就是达到元素原子稳定存在形式的唯一目的。那么,请回答:
(1)水分子的组成为什么是H2O而不是H3O。
你的解释是 。
(2)稀有气体分子中为什么不存在化学键?
你的解释是。
在短周期元素中,由三种非金属元素组成的既有离子键又有共价键,且阴阳离子含电子总数相等的物质其名称是____________,化学式是______________________。
科学家们在探索生命奥妙过程中,认识到生命细胞的组成和元素周期律有密切的关系,约占人体质量99.97%的11种大量元素全部位于周期表前20号元素,其余的是十多种人体不可缺少的微量元素。现有a~g7种短周期元素,是氧、硫、钾、钙外的其它大量元素,它们在元素周期表中的位置如下,并据此回答下列问题:
| a |
|||||||
| d |
e |
||||||
| b |
c |
f |
g |
(1)元素的原子间最容易形成离子键的是下列中的,元素的原子间最容易形成共价键的是下列中的。
A、c和fB、b和gC、d和gD、b和e
(2)下列由a~g形成的各分子中所有原子都满足最外层为8电子结构的是()
A、ea3B、agC、fg3D、dg4
A、B、C、D、E、F的原子序数依次增大,它们都是同周期的元素。已知:A、C、F
三种原子最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水;D元素原子的最外层电子数比次外层电子数少4;E元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素的符号:A____________,B____________,E____________。
(2)B的单质在F的单质中燃烧的现象是____________,化学方程式是__。
(3)A、C两种元素的最高价氧化物的水化物反应的离子方程式是_______
1971年美国的斯图杰尔和阿佩里曼在0℃ 以下将氟气从细冰末上通过,成功地合成了一直认为不存在的氟的含氧酸——次氟酸。
(1)写出次氟酸的结构并指出各元素的化合价__________________;
(2)次氟酸刹那间被热水分解得到既可表现氧化性 (对NaI)又可表现还原性(对KMnO4)的溶液,写出反应的化学方程式______________________________________。