1773年,伊莱尔·罗埃尔(Hilaire Rouelle)发现尿素。1828年,弗里德里希·维勒首次使用无机物质氰酸钾[KCNO]与硫酸铵人工合成了尿素[CO(NH2)2]。
(1)维勒合成尿素的化学反应方程式为 。
(2)工业上尿素是由CO2和NH3在一定条件下合成,其反应方程式为 当氨碳比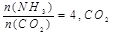 的转化率随时间的变化关系如图1所示。
的转化率随时间的变化关系如图1所示。
①A点速率v逆(CO2) 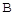 点速率为V正(CO2)(填“大于”、“小于”或“等于”)
点速率为V正(CO2)(填“大于”、“小于”或“等于”)
②NH3的平衡转化率为 。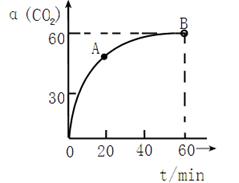
(3)人工肾脏可用间接电化学方法除去代谢产物中的尿素,原理如图2。
①电源的负极为 (填“A”或“B”)。
②阴极室中发生的电极反应式为
③电解结束后,阴极室溶液的pH与电解前相比将 (填“增大”、“减小”、“不变”)若两极共收集到气体11.2L(标准状况),则除去的尿素为 g(忽略气体的溶解)。
(15分)常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式__________________________。
(2)若溶液M由10mL 2 mol•L-1NaHA溶液与2mol•L-1NaOH溶液等体积混合而得,则溶液M的pH ________7 (填“>”、“<”或“=”),溶液中离子浓度由大到小顺序为。
(3)若溶液M由下列三种情况:①0.01mol•L-1的H2A溶液②0.01mol•L-1的NaHA溶液(常温下,其pH>7)③0.02mol•L-1的HCl与0.04mol•L-1的NaHA溶液等体积混合液,则三种情况的溶液中H2A分子浓度最大的为;pH由大到小的顺序为。
(4)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液c(H+)/c(OH-)=104,V1与V2的大小关系为_________(填“大于、等于、小于”或“均有可能”)。
(5)已知Ksp(BaA)= 1.8×10-10,向⑵的混合溶液中加入10mL 1 mol•L-1 BaCl2溶液,混合后溶液中的Ba2+浓度为___________ mol•L-1。
(12分)如果类似于水的离子积Kw,溶液中c(Ag+)和c(Cl-)的乘积是一个常数:c(Ag+)·c(Cl-)=1.0×10-10,当溶液中c(Ag+)·c(Cl-)大于1.0×10-10时,才可能产生AgCl沉淀。现向50mL 0.018mol·L-1AgNO3溶液中加入50mL 0.02mol·L-1的盐酸(忽略溶液体积变化),生成了沉淀。求:
(1)沉淀生成后溶液中c(Ag+)=。
(2)沉淀生成后溶液的pH=。
(3)如果向沉淀生成后的溶液中再加入50mL 0.001mol·L-1的盐酸,观察到的现象是:;
原因是(计算说明):。
(10分)常温下,如果取0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液中由水电离出的c(H+)_______0.1mol/LNaOH溶液中由水电离出的c(H+)。(填“>”、“<”或“=”)
(2)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断NH4HCO3溶液的pH_______7(填“大于”、“小于”或“等于”);
(3)将同温度下等浓度的四种盐溶液:
A.NH4HCO3B.NH4AC.(NH4)2SO4D.NH4Cl
按pH由大到小的顺序排列是:______________(填序号)。
(4)求出混合液中下列算式的精确计算结果(填具体数字):
c(Na+)-c(A-)=_________mol/L,c(OH-)-c(HA)=_________mol/L
在盛有AgNO3、HCl、Na2CO3、CaCl2、NaCl、KCl六种无色溶液的试剂瓶上分别贴有①~⑥的编号,分别取它们两两混合,产生的现象如下表所列(其中“↑”表示产生气体,“↓”表示生成沉淀,“—”表示无现象):
| ① |
② |
③ |
④ |
⑤ |
⑥ |
|
| ① |
— |
— |
↓ |
↓ |
↑ |
|
| ② |
— |
— |
— |
↓ |
— |
|
| ③ |
— |
— |
— |
↓ |
— |
|
| ④ |
↓ |
— |
— |
↓ |
— |
|
| ⑤ |
↓ |
↓ |
↓ |
↓ |
↓ |
|
| ⑥ |
↑ |
— |
— |
— |
↓ |
(1)推断下列编号对应的溶液(写溶质的化学式):
①_______,④_______,⑤________,⑥________。
(2)向①与⑤反应后的生成物中加入足量HNO3溶液,反应的离子方程式为__________________。
(3)通过以上实验,还有两种溶液不能确定,若要进一步确定它们,必须进行的实验是________________
用质量分数为36.5 % 的浓盐酸(密度为1.2 g·cm-3)配制成250 mL 1.2 mol/L的稀盐酸。
(1)经过计算需要_______mL浓盐酸。
(2)在量取浓盐酸后,进行了如下操作:
①等稀释的盐酸冷却到室温后,将溶液沿玻璃棒小心地注入到250 mL的容量瓶中。
②往容量瓶中缓慢地加入蒸馏水至液面接近刻度线1 cm~2 cm处时,改用胶头滴管加蒸馏水,使溶液的凹液面正好与容量瓶的刻度线相切。
③在盛浓盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗液全部注入容量瓶中。
上述操作中,正确的顺序是______________(填编号)。
(3)配制完后,将容量瓶中的稀盐酸转移到指定的试剂瓶中存放,盖好塞子并贴上标签。