镇痉药物C,化合物N以及高分子树脂(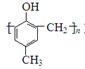 )的合成路线如下:
)的合成路线如下: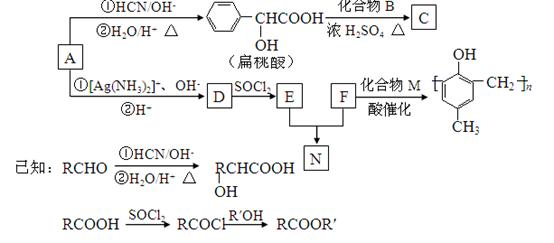
(1)A的含氧官能团的名称是 。
(2)A在催化剂作用可与H2反应生成B,该反应的反应类型是 。
(3)酯类化合物C的分子式是C15H14O3,其结构简式是 。
(4)A发生银镜反应的化学方程式是 。
(5)扁桃酸(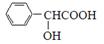 )有多种同分异构体。属于甲酸酯且含酚羟基的同分异构体有 种,写出其中一个含亚甲基(-CH2-)的同分异构体的结构简式______________。
)有多种同分异构体。属于甲酸酯且含酚羟基的同分异构体有 种,写出其中一个含亚甲基(-CH2-)的同分异构体的结构简式______________。
(6)N在NaOH溶液中发生水解反应的化学方程式是 。
(Ⅰ)化学平衡常数K表示可逆反应的进行程度,K值越大,表示
;K值大小与温度的关系是:温度升高,K值
(填“一定增大”、“一定减小”、或“可能增大也可能减小”)。
(Ⅱ)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=。
(2)该反应为反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是(多选扣分)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.υ正(H2)=υ逆(H2O)D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为℃。
(5)某温度下,将CO和水蒸气各1mol置于密闭容器中反应,达到平衡后测得CO2为0.6mol,再通入4mol水蒸气,达到新的平衡后CO2的物质的量的范围是__________。
电解原理在化学工业中有广泛的应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,
实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X电极上的电极反应是,
在X极附近观察到的现象是。
②Y电极上的电极反应,
检验该电极反应产物的方法是。
(2)若X和Y仍均为惰性电极,a为CuSO4溶液,则电解时的化学反应方程式为_____
_________________________。通过一段时间后,向所得溶液中加入16gCuO粉末,恰好恢复到电解前的浓度和pH,则电解过程中转移的电子的物质的量为__________。
(3)如果用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是___________,电极反应式是_________________________。
②Y电极的材料是___________,电极反应式是_________________________。
(说明:杂质发生的电极反应不必写出)
在25℃时,对于0.1mol·L-1的氨水,请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中 将(填“增大”、“减小”或“不变”);
将(填“增大”、“减小”或“不变”);
(2)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,此时溶液的pH 7(填“大于”、“小于”或“等于”),用离子方程式表示其原因
,此时溶液中各离子浓度由大到小的顺序为;
(3)若向氨水中加入0.05mol·L-1稀硫酸至溶液正好呈中性,所用氨水的体积V1与稀硫酸的体积V2的关系为V1V2(填“大于”、“小于”或“等于”),写出溶液中各离子浓度之间满足的电荷守恒表达式。
(9分)(1)已知25℃、101kPa时,一些物质的燃烧热为:
| 化学式 |
CO(g) |
H2(g) |
CH3OH(l) |
| ΔH/( kJ·mol-1) |
-283.0 |
-285.8 |
-726.5 |
请回答下列问题:①该条件下CH3OH(l)完全燃烧的热化学方程式为:__________________________。
②根据盖斯定律完成下列反应的热化学方程式:CO(g)+2H2(g)===CH3OH(l)ΔH=____________。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
① CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1="+49.0" kJ·mol-1
② CH3OH(g)+ O2(g)= CO2(g)+2H2(g)△H2
O2(g)= CO2(g)+2H2(g)△H2
已知H2(g)+  O2(g)===H2O(g)△H =" -241.8" kJ·mol-1
O2(g)===H2O(g)△H =" -241.8" kJ·mol-1
则反应②的△H2= kJ·mol-1。
(3)甲醇燃料电池的结构示意图如下。甲醇进入极(填“正”或“负”),正极发生的电极反应为。
(11分)有A、B、C、D、E五种短周期元素,它们的核电荷数按C、A、B、D、E的顺序依次增大。C、D都能分别与A按原子个数比为1∶1或2∶1形成化合物。CB可与EA2反应生成C2A和气态物质EB4。E的M层电子数是K层电子数的2倍。
(1)写出A、B、E元素的名称A:__________;B:_______________; E :;
(2)写出电子式D2A2__________;
(3)写出D单质与CuSO4溶液反应的离子方程式_________________________
(4)C2A是由__________键形成的________分子 (填“极性”或“非极性”);中心原子杂化类型是,分子立体构型是。