(10分)置换反应的通式可表示为(转化中涉及的均为中学化学的常见物质):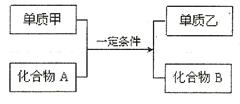
请回答下列问题:
(1)若单质甲与化合物A发生的反应常用于野外焊接钢轨,则该反应的化学方程式为 ;
(2)若甲、乙分别是同主族的两种非金属固体单质,则化合物A的一种主要用途是 ;
(3)若甲、乙分别是同主族短周期元素的两种单质,化合物B是一种强碱,则反应的离子方程式为 ;
(4)若组成单质乙的元素的最外层电子数是次外层电子数的2倍,金属单质甲能在化合物A中燃烧,则该反应中氧化剂与还原剂的物质的量之比为 ;若反应中生成2.4g单质乙,则消耗的化合物A在标准状况下的体积为 。
已知X、Y、Z三种短周期主族元素在元素周期表中的位置关系如图所示。
| Z |
|
| Y |
X |
请回答:(1)三种元素中原子半径最大的是(填X、Y或Z)
(2)若X的单质是黄绿色气体,则X和Y的最高价氧化物对应的水化物的酸性强弱顺序为(用化学式表示),和X同主族元素氢化物中熔沸点最高的是(用化学式表示),原因是;X单质溶于水生成物之一具有漂白性,写出该物质结构式。
(3)若X的单质与强酸、强碱溶液反应均能放出氢气,则元素X在周期表中的位置写出X单质和烧碱溶液反应的离子方程式
探究X和Y两种元素金属性强弱的实验方法是。
(4)若Y的氧化物是制造光导纤维的材料,则Y元素的名称是,
工业上利用单质Z和Y的氧化物高温下反应,生成一种具有空间立体网状结构的化合物,另一种生成物是有毒气体,写出反应化学方程式。
已知下列几种物质:(1)晶体Si(2)氩(3)磷(4)乙炔(5)SO2(6)SiO2(7)CaF2(8)CO2(9)K2O2
请用编号填写下列空白:
| A.通过非极性键形成原子晶体的是 |
| B.固态时属于离子晶体且含有共价键的是 |
| C.晶体中不含化学键的是 |
| D.既有极性键也有非极性键的分子晶体是 |
E、含有极性键且是非极性分子的是
喹硫平可用于精神疾病的治疗,其结构为:
(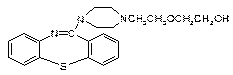 )2·
)2·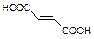 ,它的合成路线如下:
,它的合成路线如下: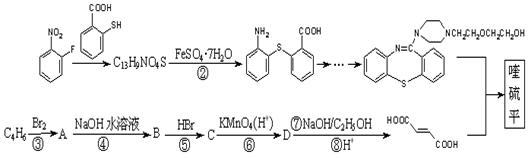
请回答下列问题:
⑴写出分子式为C13H9NO4S的物质的结构简式。
⑵物质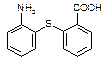 中除硫醚键(-S-)外,还含有的官能团名称为。
中除硫醚键(-S-)外,还含有的官能团名称为。
⑶反应⑦的类型是反应,反应⑤的目的是。
⑷写出反应④的化学方程式。
⑸以 为原料合成
为原料合成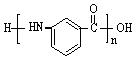 (用合成路线流程图表示,并注明反应条件)。
(用合成路线流程图表示,并注明反应条件)。
提示:①已知:苯环上的羧基为间位定位基,如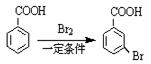 (主产物);
(主产物);
②合成过程中无机试剂任选,可以利用本题中相关信息。
X、Y都是芳香族化合物,均为常见食用香精,广泛用于化妆品、糖果及调味品中。1 mol X水解得到1 mol Y和1 mol CH3CH2OH,X、Y的分子量都不超过200,完全燃烧都只生成CO2和H2O。且X分子中碳和氢元素总的质量百分含量约为81.8%。
(1) X、Y分子量之差为_____________。
(2)1个Y分子中应该有________个氧原子。
(3) X的分子式是_______________。
(4) G和X互为同分异构体,且具有相同的官能团,E具有酸性,用芳香烃A合成G路线如下:
① 写出A的结构简式
② E→F的反应类型是反应,该反应的化学方程式为:。
③ 写出D与新制Cu(OH)2反应的化学方程式:
④ 写出E物质生成高分子化合物的反应方程式:
⑤ 写出所有符合下列条件的F的同分异构体的结构简式:。
ⅰ.分子内除了苯环无其他环状结构,且苯环上有2个对位取代基。
ⅱ.一定条件下,该物质既能与银氨溶液发生银镜反应又能和FeCl3溶液发生显色反应。
苯丙酸诺龙是一种兴奋剂,结构简式为
(1)由苯丙酸诺龙的结构推测,它能(填代号)。
a.使溴的四氯化碳溶液褪色
b.使酸性KMnO4溶液褪色
c.与银氨溶液发生银镜反应
d.与Na2CO3溶液作用生成CO2
苯丙酸诺龙的一种同分异构体A,在一定条件下可发生下列反应:
据以上信息回答(2)~(4)题:
(2)B→D的反应类型是。(3)C 的结构简式为。
(4)F→G的化学方程式是。