在同温、同压下,下列各组热化学方程式中,△H1>△H2的是
| A.2H2O(g) = 2H2(g) + O2(g)△H1 2H2O(l) = 2H2(g) + O2(g)△H2 |
| B.S (g) + O 2(g) = SO2(g)△H1 S (s) + O 2(g) = SO2(g)△H2 |
| C.2C (s) + O 2(g) = 2CO (g)△H1 2C (s) + 2O 2(g) = 2CO2 (g)△H2 |
| D.H2(g) + Cl2(g) = 2HCl(g)△H1 |
2HCl(g) = H2(g) + Cl2(g) △H2
在10 L密闭容器中,把10 mol M和10 mol N混合发生如下反应:
3M(g)+N(g) 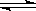 xP(g)+2Q(g),当反应达到平衡时,生成4 mol Q,并测得P的平衡浓度为0.4 mol·L-1,下列叙述中正确的是
xP(g)+2Q(g),当反应达到平衡时,生成4 mol Q,并测得P的平衡浓度为0.4 mol·L-1,下列叙述中正确的是
| A.M的转化率为80% | B.x的值为2 |
| C.N的平衡浓度为0.6 mol·L-1 | D.Q的体积分数为40% |
在一定条件下,对于A2(g)+3B2(g) 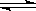 2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
A.v(B2)=1.2 mol·L-1·s -1 -1 |
B.v(A2)=0.8 mol·L-1·s |
| C.v(AB3)=1.0 mol·L-1·s-1 | D.v(A2)=30 mol·L-1·min-1 |
在相同温度时,100mL0.01mol•L-1的醋酸溶液与10mL 0.1mol•L-1的醋酸溶液相比较,下列数值中,前者大于后者的是
| A.H+的物质的量 | B.醋酸的电离平衡常数 |
| C.中和时所需NaOH的量 | D.H+的物质的量浓度 |
0.02mol·L—1的HCN溶液与0.02mol·L—1的NaCN溶液等体积混合,已知混合溶液中C(CN-)<C(Na+),则下列关系中,正确的是:
| A.C(Na+)>C(CN-)>C( H+)>C(OH-) |
| B.C(HCN)+C (CN-)=0.04mol·L-1 |
| C.C(CN-)>C(HCN) |
| D.C(Na+)+C(H+)= C(CN-)+C(OH-) |
下列与化学反应能量变化相关的叙述正确的是
A.反应物总能量一定大于生成物总能 量 量 |
| B.放热反应的反应速率总是大于吸热反应的反应速率 |
| C.应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| D.同温同压下,H2(g)+Cl2(g) |