用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积)。下列分析正确的是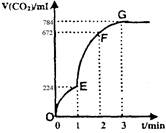
| A.OE段表示的平均速率最快 |
| B.EF段,用盐酸表示该反应的平均反应速率为0.04mol/(L·min) |
| C.OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2:6:7 |
| D.G点表示收集的CO2的量最多 |
下列关于实验基本操作的叙述不正确的是( )
| A.使用分液漏斗和容量瓶时,首先要查漏 |
| B.蒸馏实验中,要在烧瓶中加入几粒沸石或碎瓷片,以防止液体暴沸 |
| C.向试管中加液体时,胶头滴管不能紧贴试管内壁 |
| D.用蒸发皿进行加热蒸发时,一定要垫石棉网 |
下列关于某些离子的检验及结论,一定正确的是( )
| A.加入氯化钙溶液产生白色沉淀,则该溶液一定有CO32- |
| B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则一定有SO42- |
| C.加入烧碱溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,则一定有 NH4+ |
| D.加入Na2CO3溶液产生白色沉淀,再加盐酸,白色沉淀消失,则一定有Ba2+ |
下列各组中的两种物质在溶液中的反应,可用同一离子方程式表示的是( )
| A.Ba(OH)2 和 盐酸;Ba(OH)2和 H2SO4 |
| B.BaCl2和 Na2SO4;Ba(OH)2和 (NH4)2SO4 |
| C.NaHCO3 和 H2SO4;Ca(HCO3)2和 HNO3 |
| D.Ba(OH)2和 HNO3; Cu(OH)2和 H2SO4 |
已知有如下反应:①ClO3-+5Cl- +6H+=3Cl2+3H2O, ②2FeCl3+2KI=2FeCl2+2KCl+I2,
③2FeCl2+Cl2 =2FeCl3, 判断下列各微粒氧化能力由强到弱的顺序正确的是( )
| A.Cl2 > ClO3- > Fe3+ > I2 | B.Cl2 > ClO3- > I2 > Fe3+ |
| C.ClO3- > Cl2 > Fe3+ > I2 | D.ClO3- > Fe3+ > Cl2 > I2 |
在甲、乙两烧杯溶液中,分别含有大量的Cu2+、K+、H+、Cl-、CO32-、OH- 离子中的3种,已知甲烧杯的溶液呈蓝色,则乙烧杯的溶液中大量存在的离子是( )
| A.Cu2+、H+、Cl- | B.CO32-、OH-、Cl- |
| C.K+、H+、Cl- | D.K+、OH-、CO32- |