.下列关于化学键的说法正确的是
| A.构成单质分子的微粒一定含有共价键 |
| B.全部由非金属元素组成的化合物不一定是共价化合物 |
| C.非极性键只存在于双原子单质分子中 |
| D.不同元素组成的多原子分子里的化学键一定都是极性键 |
FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、NO的物质的量之比为1︰1︰1时,实际参加反应的FeS与HNO3的物质的量之比为()
| A.1∶6 | B.1∶7 | C.2∶11 | D.16∶25 |
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是()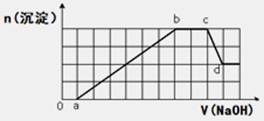
| A.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 |
| B.ab段发生的离子反应为:Al3++3OH-= Al(OH)3↓,Mg2++2OH-= Mg(OH)2↓ |
| C.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+、Na+ |
| D.d点溶液中含有的溶质只有Na2SO4 |
相同物质的量的下列物质:①金属钠②烧碱③过氧化钠④氧化钠,长期放置在空气中(不考虑潮解和水解),质量都会增加,按增加的质量由大到小排列,正确的是()
| A.①>②>④>③ | B.①>②>③>④ |
| C.④>①>③>② | D.④>①>②>③ |
可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解质溶液,铝合金为负极,空气电极为正极。下列说法正确的是()
| A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-=4OH- |
| B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e=Al(OH)3↓ |
| C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变 |
| D.电池工作时,电子通过外电路从正极流向负极 |
在100 mL 12 mol/L的浓盐酸中加入足量的MnO2加热,充分反应后得到Cl2的物质的量是(不考虑Cl2在反应过程中的任何损失)()
| A.0.6 mol | B.在0.3~0.6 mol之间 | C.0.3 mol | D.小于0.3 mol |