在T℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g·cm-3,溶质的质量分数为w,其中含NH4+的物质的量为b mol。下列叙述中正确的是( )
A.溶质的质量分数为w=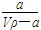 ×100% ×100% |
B.溶质的物质的量浓度c=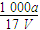 mol·L-1 mol·L-1 |
C.溶液中c(OH-)= mol·L-1 mol·L-1 |
| D.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w |
已知常温下在溶液中可发生如下两个离子反应:
Ce 4+ +Fe2+ ="Fe" 3+ +Ce3+ Sn2+ +2Fe3+ =2Fe2+ +Sn4+
由此可以确定Fe 2+ 、Ce 3+ 、Sn 2+ 三种离子的还原性由强到弱的顺序是
| A.Sn 2+ 、Fe 2+ 、Ce 3+ | B.Sn 2+ 、Ce 3+ 、Fe 2+ |
| C.Ce 3+ 、Fe 2+ 、Sn 2+ | D.Fe 2+ 、Sn 2+ 、Ce 3+ |
为了科学饮食,了解一些与食品相关的化学知识是必要的。
(1)油炸虾条、薯片等容易挤碎的食品,不宜选用真空袋装,而应采用充气袋装。下列气体中不应该充入的是________。
A.氮气 B.二氧化碳 C.空气D.氧气
(2)为使以面粉为原料的面包松软可口,通常用碳酸氢钠作发泡剂,因为它________。
①热稳定性差②增加甜味③产生二氧化碳④提供钠离子
A.②③B.①③C.①④ D.③④
(3)能直接鉴别氯化钠和葡萄糖两种未知浓度溶液的方法是________。
A.观察颜色 B.测量比重C.加热灼烧D.分别闻味
(4)苯甲酸钠是常用的食品防腐剂,其结构简式如图 。以下对苯甲酸钠描述错误的是________。
。以下对苯甲酸钠描述错误的是________。
A.属于盐类B.能溶于水C.属于烃类 D.不易分解
一种有机物的结构简式为: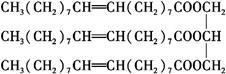
试回答下列问题:
(1)该化合物的种类是 。
A.烯烃B.酯C.油脂D.高分子化合物
(2)该化合物的密度 。
A.比水大B.比水小
(3)该化合物常温下的状态为 。
A.液体B.固体 C.气体
(4)与该物质能反应的物质有 。
A.NaOH(aq)
B.碘水
C.乙醇
D.乙酸
E.H2
下列关于油脂的说法中,不正确的是
A.油脂水解后的产物经氧化为人体提供热能
B.油脂能溶解维生素A、D、E、K
C.油脂能储备热能
D.多吃动物脂肪比多吃植物油好
人类肝脏蛋白质两谱三图三库将于2010年全面破译完成,它将为肝脏疾病的预警、预防、诊断和治疗提供科学依据。下列关于乙肝病毒的说法不正确的是
| A.属于高分子化合物 |
| B.水解的最终产物能与酸或碱反应 |
| C.遇浓硝酸会变性 |
| D.水解时碳氧键断裂 |