下列各组中的两种物质相互反应时,无论哪种过量,都可以用同一个离子方程式表示的是:( )
①碳酸钠溶液与盐酸 ②偏铝酸钠溶液与盐酸 ③苯酚钠溶液与CO2
④硝酸银溶液与氨水 ⑤氯化铝溶液与氨水 ⑥碳酸氢钠溶液与澄清的石灰水
| A.③⑤ | B.①③⑥ | C.仅有⑤ | D.②④ |
新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水。工业上常通过以下两步反应制备K2FeO4:
① 2FeCl3+10NaOH+3NaClO = 2Na2FeO4+9NaCl+5H2O
② Na2FeO4 + 2KOH ="=" K2FeO4 + 2NaOH
下列说法不正确的是
| A.反应①为氧化还原反应,反应②为复分解反应 |
| B.反应①中NaClO 是氧化剂 |
| C.Na2FeO4 中Fe为+4价,具有强氧化性,能杀菌消毒 |
| D.若有2 mol FeCl3发生反应,转移电子的物质的量为 6 mol |
根据下列化学方程式,判断有关物质的还原性强弱的顺序为
① I2+SO2+2H2O=H2SO4+2HI;
② 2FeCl2+Cl2=2FeCl3;
③ 2FeCl3+2HI=2FeCl2+2HCl+I2
| A.I->Fe2+>Cl->SO2 | B.SO2>I->Fe2+>Cl- |
| C.Fe2+>I->Cl->SO2 | D.Cl->Fe2+>SO2>I- |
下列离子方程式改写成化学方程式正确的是
| A.Cu2++2OH-=Cu(OH)2¯ CuCO3+2NaOH=Cu(OH)2¯+Na2CO3 |
B.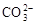 +2H+=CO2+H2O BaCO3+2HCl=BaCl2+CO2+H2O +2H+=CO2+H2O BaCO3+2HCl=BaCl2+CO2+H2O |
C.Ca2++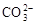 =CaCO3¯Ca(NO3)2+Na2CO3=CaCO3¯+2NaNO3 =CaCO3¯Ca(NO3)2+Na2CO3=CaCO3¯+2NaNO3 |
| D.H++OH-=H2O Ba(OH)2+H2SO4=BaSO4 ¯+2H2O |
在水溶液中能大量共存,且加入过量稀硫酸溶液时,有气体生成的是
| A.Na+、Ag+、CO32- 、Cl- | B.K+ 、Ba2+ 、SO42- 、Cl- |
| C.Na+、K+、CO32- 、Cl- | D.Na+ 、K+ 、Cl-、SO42— |
硫酸钾和硫酸铝的混合溶液,已知其中Al3+的浓度为0.4 mol/L,硫酸根离子浓度为0.7 mol/L,则K+的物质的量浓度为
| A.0.1 mol/L | B.0.2 mol/L | C.0.3 mol/L | D.0.15 mol/L |