若以w1和w2分别表示物质的量是浓度为c1 mol/L和c2 mol/L氨水溶液的质量分数,已知2 w1=w2,则下列推断正确的是 (已知氨水的密度小于纯水的密度)
| A.2c1=c2 | B.2c2=c1 | C.c2>2c1 | D.c1<c2<2c1 |
下列依据实验目的所设计的实验操作中正确的是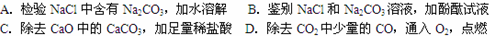
下列实验中所选用的仪器正确的是
| A.用200mL量筒量取5.2mL稀硫酸 |
| B.用托盘天平称量11.7g氯化钠固体 |
| C.用瓷坩埚灼烧纯碱 |
| D.用50mL烧杯配制100g质量分数为5%的食盐水 |
P单质在反应4P+3KOH+3H2O===3KH2PO2+PH3中的变化是
| A.被氧化 | B.被还原 |
| C.既被氧化又被还原 | D.既未被氧化又未被还原 |
下列 各组的两种物质在溶液中的反应,可用同一离子方程式表示的是
各组的两种物质在溶液中的反应,可用同一离子方程式表示的是
| A.氢氧化钠与盐酸;氢氧化钠与醋酸 |
B.BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2S O4溶液 O4溶液 |
| C.Na2CO3溶液与硝酸溶液;CaCO3溶液与硝酸溶液 |
| D.石灰石与硝酸反应;石灰石与盐酸 |
下列离子方程式正确的是
A.氯化亚铁溶液中通入少量氯气 Fe2+ + Cl2 = Fe3+ +2Cl—
B.向溴化亚铁溶液中通入过量氯气:Fe2+ + 2Br— + 2Cl2 ="=" Fe3+ + Br2 + 4Cl—
C .向碳酸氢铵溶液中加入足量的NaOH溶液:NH4+ +OH-= NH3·H2O
.向碳酸氢铵溶液中加入足量的NaOH溶液:NH4+ +OH-= NH3·H2O
D.等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合时发生反应:
HCO3-+Ba2++OH-BaCO3↓+H2O