已知某KOH样品中含水7.62%,含K2CO3 2.23%,含KOH 90%。现将1.00g 样品加入46.00mL 1.00mol/L的盐酸中,过量的酸用1.070mol/L KOH溶液中和。蒸发溶液,蒸发到无水时,可得的固体的质量
| A.3.00g | B.3.43g | C.4.50g | D.无法计算 |
设NA为阿伏加德罗常数的值。下列说法正确的是()
| A.常温常压下,17g甲基(—14CH3)所含的中子数为9NA |
| B.标准状况下,将2.24L Cl2溶于水,可得到HClO分子的数目是0.1NA |
| C.42.0 g乙烯和丙烯的混合气体中含有的碳原子数为3NA |
| D.5.6g铁与0.1mol氯气在点燃条件下充分反应,转移的电子数为0.3NA |
化学在生产和日常生活中有着重要的应用。下列叙述正确的是( )
| A.盐酸滴定氨水,可以选择酚酞为指示剂 |
| B.电离程度(同温度同浓度溶液中):HCl>CH3OOH>NaHCO3 |
| C.分散质粒子的直径:FeCl3溶液>Fe(OH)3胶体>Fe(OH)3悬浊液 |
| D.若要使Na2S溶液中c(Na+)/c(S2-)的值减小,可以加入适量的KOH固体 |
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体V L(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0 g,若上述气体为NO和NO2的混合物,且体积比为1:1,则V可能为( )
| A.8.4 L | B.13.5 L | C.10.7 L | D.16.8 L |
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
| 实验编号 |
起始浓度/(mol·L-1) |
反应后溶液的pH |
|
| c(HA) |
c(KOH) |
||
| ① |
0.1 |
0.1 |
9 |
| ② |
x |
0.2 |
7 |
下列判断不正确的是( )
A.实验①反应后的溶液中:c(K+) > c(A—) > c(OH—) > c(H+)
B.实验①反应后的溶液中:c(OH—) = c(K+) — c(A—) =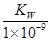 mol/L
mol/L
C.实验②反应后的溶液中:c(A—) + c(HA) > 0.1 mol/L
D.实验②反应后的溶液中:c(K+) = c(A—) > c(OH—) = c(H+)
为减小CO2对环境的影响,在倡导“低碳”的同时,还需加强对CO2创新利用的研究。T1℃时,将9molCO2和12molH2充入3L密闭容器中,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH<0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为P1。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线II所示。下列说法错误的是( )
CH3OH(g)+H2O(g)ΔH<0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为P1。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线II所示。下列说法错误的是( )
| A.曲线II对应的条件改变是增大压强 |
| B.T2℃时,上述反应平衡常数为0.42,则T2>T1 |
| C.在T1℃,若起始时向容器中充入 5 mol CO2、5 mol H2、5 mol CH3OH(g)和5 mol H2O(g),则达平衡前v(正)>v(逆) |
D.在T1℃,若起始时向容器中充入4.5molCO2、6mol H2 ,平衡时容器内压强p=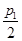 |