下列溶液中的Cl-的物质的量浓度与100mL 1 mol•L―1AlCl3溶液中Cl-的物质的量浓度相等的是
| A.150mL 1 mol•L―1的MgCl2溶液 | B.150mL 1 mol•L―1的FeCl2溶液 |
| C.50mL 3 mol•L―1的KCl溶液 | D.300mL 1 mol•L―1的NaCl溶液 |
下列单质或化合物性质的描述正确的是
| A.NaHSO4水溶液显中性 |
| B.SiO2与酸、碱均不反应 |
| C.NO2溶于水时发生氧化还原反应 |
| D.Fe在足量Cl2中燃烧生成FeCl2和FeCl3 |
下列说法正确的是
| A.强电解质一定易溶于水 |
| B.常温下,强酸和弱酸的浓度相同时,强酸中水的电离程度比弱酸的水的电离程度小 |
| C.对可逆反应,升高温度一定存在v(正)>v(逆) |
| D.钢铁在海水中发生电化腐蚀时,铁是正极被氧化 |
在不同温度下,向VL密闭容器中加入0.5 mol NO和0.5 mol活性炭,发生反应:2NO(g)+C(s) N2(g)+CO2(g) △H=—QkJ·mol-1 (Q>0),达到平衡时的数据如下:
N2(g)+CO2(g) △H=—QkJ·mol-1 (Q>0),达到平衡时的数据如下:
| 温度/℃ |
n (C)/mol |
n(CO2)/mol |
| T1 |
0. 15 |
|
| T2 |
0. 375 |
下列有关说法正确的是
A.由上述信息可推知:T1>T2
B.T2℃时,若反应达平衡后再缩小容器的体积,c(N2):c(NO)增大
C.T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率增大
D. T1℃时,该反应的平衡常数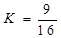
对下列电解质溶液的叙述错误的是
| A.等物质的量浓度的Na2CO3和NaHCO3混合液中:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
| B.25℃时 0.2 mol·L-1盐酸与等体积0. 05 mol.L-lBa(OH)2溶液混合后,溶液的pH=l |
| C.pH=3的二元弱酸H2R溶液与pH=ll的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液中:2c(R2-)+c(HR-)=c(Na+) |
| D.25℃时,若0.3 mol.L-1 HY溶液与0.3 mol.L-l NaOH溶液等体积混合后,溶液的 pH=9,则:c(OH-)-c(HY)=1×l0-9 mol.L-1 |
下列实验结论正确的是
| 选项 |
实验操作 |
现象 |
结论 |
| A |
取待测液先进行焰色反应,再加足量稀盐酸,将产生气体通入品红溶液 |
火焰呈黄色,品红溶液褪色 |
原溶液一定是亚硫酸钠溶液 |
| B |
向浓醋酸溶液中加入少量碳酸钠溶液,将产生气体通入苯酚钠溶液 |
苯酚钠溶液中出现白色浑浊 |
说明酸性:醋酸>碳酸>苯酚 |
| C |
常温下向足量浓硫酸和稀硫酸中,分别加入相同质量、相同体积的铁片 |
相同时间两者产生H2速率不同 |
反应物的浓度越大,反应速率越快 |
| D |
相同的铝片分别与同温同体积,且c(H+)="1" mol·L¯1的盐酸、硫酸反应 |
铝与盐酸反应产生气泡较快 |
可能是Cl-对该反应起到促进作用 |