(1)3.01×1022个OH¯的物质的量为 ;这些OH¯与 molNH3的质量相等,与 g Na+含有的离子数相同。
(2)在标准状况下,2.24LNOx气体的质量为4.6g,则x的值为 。
(3)有四种正盐的混合溶液,含有0.2 mol·L-1 Na+、0.25 mol·L-1 Mg2+、0.4mol·L-1
Cl-,则SO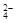 的浓度为
的浓度为
(4)、用14.2g硫酸钠配制成500mL溶液,其物质的量浓度为 mol/L。若从中取出50mL,其物质的量浓度为 mol/L,溶液中含Na+的个数为
若将这50mL溶液用水稀释到100mL, SO42-的物质的量浓度为 mol/L。
氧化还原反应有多种分类方法,其中根据参与电子转移的元素种类不同的分类方法最常见。下列所提供的反应中电子转移发生在相同价态的同种元素之间的有(填序号,下同);电子转移发生在不同价态的同种元素之间的有;电子转移发生在不同元素之间的有。
①C+CO2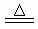 2CO②NH4NO3
2CO②NH4NO3 N2O↑+2H2O③2KClO3
N2O↑+2H2O③2KClO3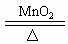 2KCl+3O2↑
2KCl+3O2↑
④S+2KNO3+3C K2S+N2↑+3CO2↑⑤3Cl2+6NaOH
K2S+N2↑+3CO2↑⑤3Cl2+6NaOH 5NaCl+NaClO3+3H2O
5NaCl+NaClO3+3H2O
⑥HgS+O2 Hg+SO2
Hg+SO2
在下列反应中:
| A.2F2+2H2O=4HF+O2 | B.2Na+2H2O=2NaOH+H2↑ |
| C.CaO+H2O=Ca(OH)2 | D.2H2O=2H2↑+O2↑ |
水只作氧化剂的是,水只作还原剂的是,水既作氧化剂又 作还原剂的是,水既不作氧化剂又不作还原剂的是。
作还原剂的是,水既不作氧化剂又不作还原剂的是。
除去括号中杂质,写出所加试剂的化学式与反应的离子方程式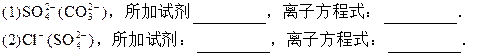
(3)Fe2+(Cu2+),所加试剂________,离子方程式:________.
某溶液中可能有下列阴离子:SO42-、CO32-、Cl-。
(1)当溶液中存在大量H+时,溶液中不能大量存在的离子是________。
(2)当溶液中存在大量的Ba2+时,溶液中不能大量存在的离子是________。
(3)当溶液中存在大量________和________离子时,上述阴离子都不能大量存在.
483 g Na2SO4·10H2O中所含的Na+的物质的量是mol,SO42—的物质的量是mol,所含H2O分子的数目是个。