如右图所示,在试管a中先加3mL乙醇,边摇动边缓缓加入2mL浓硫酸,摇匀冷却后,再加入2ml冰醋酸,充分搅动后,固定在铁架台上。在试管b中加入适量的A溶液。连接好装置,给a加热,当观察到试管b中有明显现象时,停止实验。
(1)右图所示的装置中,装置错误之处是:;
(2)A是溶液;(3)加入浓硫酸的作用是:、;
(4)乙酸跟乙醇在浓硫酸存在并加热和条件下发生的酯化反应(反应A),其逆反应是水解反应(反应B)。反应可能经历了生成中间体(Ⅰ)这一步
如果将反应按加成、消去、取代反应分类,则A—F个反应中(将字母代号填入下列空格中),属于取代反应的是;属于加成反应的是;属于消去反应的是。
请写出下列物质的化学用语:
①葡萄糖的结构简式:
②乙醛与新制氢氧化铜溶液氢氧化钠存在下发生反应的化学方程式为:;
③溴乙烷和氢氧化钠的乙醇溶液共热的反应方程式为:
④石炭酸和足量的氢氧化钠溶液反应化学方程式:
某厂废水中含5.00×10-3mol·L-1的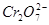 ,其毒性较大。某研究性学习小组为了变
,其毒性较大。某研究性学习小组为了变
废为宝,将废水处理得到磁性材料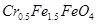 (
(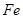 的化合价依次为+3、+2),设计了如下实验流程:
的化合价依次为+3、+2),设计了如下实验流程:


 (1)第①步反应的离子方程式是,
(1)第①步反应的离子方程式是,
(2)第②步中用PH试纸测定溶液PH的操作方法是:
,
(3)第③步过滤得到的滤渣中主要成分除Cr(OH)3外,还有,
(4)欲使1L该废水中的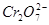 完全转化为
完全转化为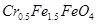 。理论上需要加入
。理论上需要加入
克FeSO4·7H2O。
在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸(以下填空分别用a、b、c表示)
(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是。
(2)同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是。
(3) 将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是。
(4)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是。
(5)当c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,则开始时反应速率的大小关系为。
在密闭容器中,保持一定温度进行如下反应N2(g)+ 3H2(g) 2NH3(g),已知加入1 mol N2和3 mol H2,在恒压条件下达到平衡时生成a mol NH3,在恒容条件下达到平衡时生成b mol NH3(见下表中编号①的一行)。若相同条件下,达到平衡时混合物中各组分的百分含量不变。回答下列问题:
2NH3(g),已知加入1 mol N2和3 mol H2,在恒压条件下达到平衡时生成a mol NH3,在恒容条件下达到平衡时生成b mol NH3(见下表中编号①的一行)。若相同条件下,达到平衡时混合物中各组分的百分含量不变。回答下列问题:
(1)写出该反应的化学平衡常数表达式:K=。
(2)平衡常数K值越大,表明建立平衡时(填字母序号)。
| A.N2的转化率越高 | B.NH3的产量越大 |
| C.正反应进行得越彻底 | D.化学反应速度越快 |
(3)a与b的关系是:ab(填>、<、=)
(4)填写下表空格:
| 状态 条件 |
起始时物质的物质的量(mol) |
平衡时NH3的物质的量 (mol) |
|||
| 编号 |
X(N2) |
Y(H2) |
Z(NH3) |
||
| 恒容 |
① |
1 |
3 |
0 |
b |
| ② |
0 |
0 |
b |
||
| ③ |
2.25 |
b |