(8分)将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:
3A(g)+B(g) xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol/(L。min),且此时A、B的物质的量浓度之比为3∶5。求:
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol/(L。min),且此时A、B的物质的量浓度之比为3∶5。求:
(1)此时A的浓度为 .反应开始前放入容器中A、B的物质的量
(2)B的平均反应速率 .
(3)x的值是多少 .
(4)下列叙述能证明该反应已达到化学平衡状态的是 。
A.溶器内压强不再发生变化
B.A的体积分数不再发生变化
C.容器内气体分子总数不再发生变化
D.相同时间内消耗3nmolA的同时消耗nmolB
E. 混合气体的平均相对分子质量不再变化
对于混合物的分离或提纯,常采用的方法有:①过滤、②蒸发、③蒸馏、④萃取、⑤加热分解等。下列各组混和物的分离或提纯应采用什么方法?(填序号)
(1)提取碘水中的碘 ___________;
(2)除去食盐溶液中的水 ___________;
(3)淡化海水 __________;
(4)KCl中含有KClO3 。
(每空2分,共16分)用某含泥沙、MgCl2、CaCl2、Na2SO4的粗盐为原料提取NaCl固体的工艺流程如下,请填空:
(1)若E主要为CaCO3、BaCO3和少量MgCO3沉淀,填写下列试剂的化学式:
① 、② 、③ 、④ ;
(2)写出C溶液中所含溶质成分的化学式:
C: 。
(3)写出加入下列试剂后所发生的化学反应方程式:
① ;
④ 、 。
物质的命名(共24分)
(1)系统命名法命名下列物质(每小题4分,共12分):
①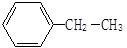 _________
_________
②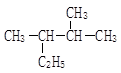 ___________
___________
③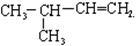 ________
________
(2)书写下列物质的结构简式(每小题4分,共12分):
①丙烷______________
②3,4-二甲基己烷______________
③间三甲苯_______________
过氧化氢(H2O2)的水溶液俗称双氧水,近年来倍受人们的青睐,被称为“绿色氧化剂”。
(1)写出H2O2的电子式 。
(2)你认为H2O2被称为“绿色氧化剂”的主要原因是 。
(3)将双氧水加入用盐酸酸化的FeCl2溶液中,溶液由浅绿色变为棕黄色,写出该反应的离子方程式为 ,反应中H2O2作 剂。
(4)双氧水能使酸性高锰酸钾溶液褪色,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里: MnO4﹣+ H2O2+ H+═ Mn2++ H2O+ 。
芳香化合物A(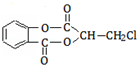 )在一定条件下可以发生如下图所示的转化(其他产物和水已略去).
)在一定条件下可以发生如下图所示的转化(其他产物和水已略去).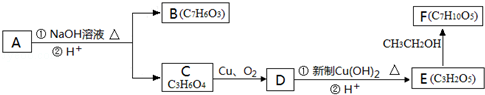
请回答下列问题:
(1)请写出A的分子式 。
(2)1mol A在氢氧化钠溶液中加热,充分反应消耗氢氧化钠 mol。
(3)有机物C可以由乳酸(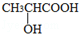 )经过几步有机反应制得,其中最佳的次序是: 。
)经过几步有机反应制得,其中最佳的次序是: 。
a.消去、加成、水解、酸化 b.氧化、加成、水解、酸化
c.取代、水解、氧化、酸化 d.消去、加成、水解、氧化
(4)写出由E制得F的化学方程式: ,反应类型是 。
(5)有机物B与乙酸酐(CH3COOCOCH3)直接反应制得阿司匹林(即乙酰水杨酸,分子式C9H8O4),满足以下条件的阿司匹林的同分异构体有 种,写出其中核磁共振氢谱是3:2:2:1的结构简式: 、 。
①苯环上只含有两个侧链
②有两个酯基
③能发生银镜反应