.下列实验操作正确的是( )
| A.分液:用分液漏斗分开汽油和植物油的混合溶液 |
| B.测pH:将pH试纸插入某溶液中,变色后与比色卡对比,读取pH |
| C.称量:用托盘天平准确称得(氢氧化钠固体+烧杯)总质量为25.56g |
| D.取量:用规格为10mL的量筒量取8.0mL液体 |
测定稀盐酸和氢氧化钠稀溶液中和热的实验中没有使用的仪器有:①大、小烧杯;②容量瓶;③量筒;④环形玻璃搅拌棒;⑤试管;⑥温度计;⑦蒸发皿;⑧托盘天平中的( )
| A.①②⑥⑦ | B.②⑤⑦⑧ | C.②③⑦⑧ | D.③④⑤⑦ |
下列说法正确的是( )
| A.中和热一定是强酸跟强碱反应放出的热量 |
| B.1 mol酸与1 mol 碱完全反应放出的热量是中和热 |
| C.在稀溶液中,酸与碱发生中和反应生成1 mol H2O(l)时的反应热叫做中和热 |
| D.测定中和热时可用稀硫酸和稀Ba(OH)2溶液 |
根据热化学方程式:S(s)+O2(g) SO2(g) ΔH=a kJ·mol-1(a=-297.2)。分析下列说法,其中不正确的是( )
SO2(g) ΔH=a kJ·mol-1(a=-297.2)。分析下列说法,其中不正确的是( )
| A.S(s)在O2(g)中燃烧的反应是放热反应 |
B.S(g)+O2(g) SO2(g) ΔH=b kJ·mol-1,则a>b SO2(g) ΔH=b kJ·mol-1,则a>b |
| C.1 mol SO2(g)所具有的能量低于1 mol S(s)与1 mol O2(g)所具有的能量之和 |
| D.16 g固体硫在空气中充分燃烧,可吸收148.6 kJ的热量 |
白磷与氧气可发生如下反应:P4+5O2 P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P a kJ·mol-1、P—O b kJ·mol-1、P
P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P a kJ·mol-1、P—O b kJ·mol-1、P O c kJ·mol-1、O
O c kJ·mol-1、O O d kJ·mol-1。
O d kJ·mol-1。
根据下图所示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )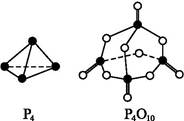
| A.(6a+5d-4c-12b) kJ·mol-1 |
| B.(4c+12b-6a-5d) kJ·mol-1 |
| C.(4c+12b-4a-5d) kJ·mol-1 |
| D.(4a+5d-4c-12b) kJ·mol-1 |
化学反应N2+3H2 2NH3的能量变化如图所示,该反应的热化学方程式是( )
2NH3的能量变化如图所示,该反应的热化学方程式是( )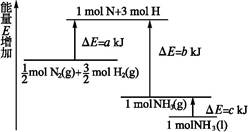
A.N2(g)+3H2(g) 2NH3(l) ΔH=2(a-b-c)kJ·mol-1 2NH3(l) ΔH=2(a-b-c)kJ·mol-1 |
B.N2(g)+3H2(g) 2NH3(g) ΔH=2(b-a)kJ·mol-1 2NH3(g) ΔH=2(b-a)kJ·mol-1 |
C.N2(g)+H2(g) NH3(l) ΔH=(b+c-a)kJ·mol-1 NH3(l) ΔH=(b+c-a)kJ·mol-1 |
D.N2(g)+H2(g) NH3(g) ΔH=(a+b)kJ·mol-1 NH3(g) ΔH=(a+b)kJ·mol-1 |