1molCO和1molCO2具有相同的( )
①分子数 ②原子数 ③ C原子数 ④ O原子数
| A.①② | B.①③ | C.①④ | D.②④ |
将0.1 mol·L-1的K2SO4溶液、0.2 mol·L-1的Fe2(SO4)3溶液混合,欲使混合液中c(Fe3+)、c(K+)、c(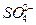 )依次为0.1 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,(设混合液的体积为各溶液体积之和)则K2SO4溶液、Fe2(SO4)3溶液及水混合时体积比是( )
)依次为0.1 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,(设混合液的体积为各溶液体积之和)则K2SO4溶液、Fe2(SO4)3溶液及水混合时体积比是( )
| A.1∶2∶1 | B.1∶1∶2 |
| C.2∶1∶1 | D.4∶2∶1 |
将物质的量浓度为6 mol·L-1的氨水溶液与等质量的水混合后,溶液的物质的量浓度( )
| A.大于3 mol·L-1 | B.等于3 mol·L-1 |
| C.小于3 mol·L-1 | D.无法判断 |
质量分数为90%的硫酸溶液和10%的硫酸溶液等体积混合后,溶液中溶质的质量分数( )
| A.大于50% | B.等于50% | C.小于50% | D.不能作上述比较 |
露置的苛性钾经分析,其中含有的各种物质的质量分数分别为:H2O 7.62%,K2CO3 2.38%,KOH 90%。若将此样品1 g加入到1 mol·L-1的盐酸46.00 mL中,过量的盐酸用1.070 mol·L-1 KOH溶液恰好中和。蒸发中和后的溶液,可得固体()
| A.3.43 g | B.4.00 g |
| C.4.50 g | D.无法计算 |
实验室需要200 mL 1 mol·L-1的CuSO4溶液,下列有关配制该溶液的叙述,正确的是()
| A.称取32 g无水硫酸铜,加入200 mL水,在250 mL的容量瓶中配成溶液 |
| B.称取50 g CuSO4·5H2O,在250 mL的容量瓶中配成200 mL溶液 |
| C.称取40 g无水硫酸铜,加入250 mL水,在250 mL的容量瓶中配成250 mL溶液 |
| D.称取62.5 g CuSO4·5H2O,在250 mL的容量瓶中配成250 mL溶液 |