氧化还原反应实际上包含氧化和还原两个过程:①向氯酸钠的酸性水溶液中通入二氧化硫,该反应中氧化过程的反应式为:SO2 + 2H2O – 2e-→ SO42-+ 4H+;②向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,该反应中还原过程的反应式为:Cl2 + 2e-→ 2Cl-,在①和②反应中均会生成产物X,则X的化学式为 ( )
| A.NaClO | B.HClO | C.ClO2 | D.NaClO4 |
下列说法正确的是
| A.水是一种非常稳定的化合物,这是由于氢键所致 |
| B.乙醇分子中有一个手性碳原子 |
| C.离子晶体的晶格能越大离子键越强 |
| D.电负性:Na﹥ Al |
下列关于化学用语的表示错误的是
A.Na+的电子排布图: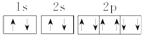 |
B.氯离子的结构示意图: 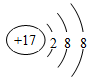 |
C.甲基的电子式: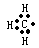 |
| D.硫离子的核外电子排布式:1s22s22p63s23p6 |
根据原子结构及元素周期律的知识,下列推断正确的是
| A.同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
| B.核外电子排布相同的微粒化学性质也相同 |
| C.Cl-、S2-、Na+、K+半径逐渐减小 |
| D.1735Cl 与1737Cl得电子能力相同 |
元素的性质呈周期性变化的根本原因是
| A.原子半径呈周期性变化 |
| B.元素的化合价呈周期性变化 |
| C.第一电离能呈周期性变化 |
| D.元素原子的核外电子排布呈周期性变化 |
X、Y、Z、W是短周期元素,X元素原子的最外层未达到8电子稳定结构,工业上通过分离液态空气获得其单质;Y元素原子最外电子层上s、p电子数相等;Z元素+2价阳离子的核外电子排布与氖原子相同;W元素原子的M层有1个未成对的p电子。下列有关这些元素性质的说法一定正确的是
| A.X元素的氢化物的水溶液显碱性 |
| B.Z元素的离子半径大于W元素的离子半径 |
| C.Z元素的单质在一定条件下能与X元素的单质反应 |
| D.Y元素最高价氧化物的晶体具有很高的熔点和沸点 |