氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是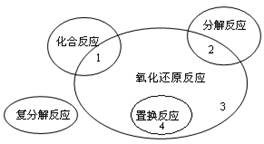
| A.Cl2+2KBrBr2+2KCl |
B.2NaHCO3 Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑ |
| C.4Fe(OH)2+O2+2H2O4Fe(OH)3 |
| D.CH4+2O2CO2+2H2O |
下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是()
| A.SO2和SiO2 | B.NaCl和HCl | C.CCl4和KCl | D.CO2和H2O |
下列分子中的中心原子杂化轨道的类型相同的是
| A.CO2与SO2 | B.CH4与NH3 | C.BeCl2与BF3 | D.C2H2与C2H4 |
某主族元素的原子,M层上有一个半充满的亚层,这种原子的质子数是
| A.只能是7 | B.只能是15 | C.是11或15 | D.是11或13 |
下列叙述正确的是
| A.正四面体构型的分子中键与键之间的夹角均是109°28′ |
| B.粒子间以分子间作用力结合而成的晶体其熔点一般不会很高 |
| C.离子晶体中含有离子键,不能含有共价键 |
| D.金属阳离子只能存在于离子晶体中 |
元素“氦、铷、铯”等是用下列哪种科学方法发现的:
| A.红外光谱 | B.质谱 | C.原子光谱 | D.核磁共振谱 |