A、B两元素的原子,分别获得两个电子形成稀有气体元素原子的电子层结构时,A放出的能量大于B放出的能量。C、D两元素的原子,分别失去一个电子,形成稀有气体元素原子的电子层结构时,D吸收的能量大于C吸收的能量。则B、A和C、D分别形成的化合物,属于离子化合物可能性最大的是( )
A.C2A B.C2B C.D2A D.D2B
NA代表阿伏加德罗常数。下列有关叙述正确的是

A.标准状况下,2.24LH2O含有的分子数等于0.1NA  |
B.常温下, 溶液中阴离子总数大于0.1NA 溶液中阴离子总数大于0.1NA  |
C.分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g  |
D.3.4 中含N—H键数目为 中含N—H键数目为 |
9.2g金属钠投入到足量的重水中,则产生的气体中含有





| A.0.2mol中子 | B.0.4mol电子  |
C.0.2mol质子 | D.0.4mol分子 |
将22.4L某气态氮氧化合物与足量的灼热铜粉完全反应后,气体体积11.2L(体积均在相同条件下测定),则该氮氧化合物的化学式为
| A.NO2 | B.N2O2 | C.N2O | D.N2O4 |
向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L。
 向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的
向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的 沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系不正确的是
沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系不正确的是

A.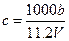 |
B.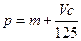 |
C.n="m+17Vc" | D.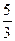 < < 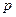 < <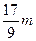 |
设nA 代表阿伏加德罗常数(NA )的数值,下列说法正确的是






A.1 mol 硫酸钾中阴离子所带电荷数为nA  |
B.乙烯和环丙烷(C3H6)组成的28g混合气体中含有3nA 个氢原子  |
C.标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为nA   |
D.将0.1mol氯化铁溶于1L水中,所得溶液含有0.1nA |