下图为周期表中短周期的一部分,若X原子最外层电子数比次外层电子数少3,则下列说法不正确的是( )
| |
R |
|
| X |
Y |
Z |
A.Y的氢化物比X的氢化物更稳定
B.原子半径大小顺序是Z>Y>X>R
C.Z的单质能与Y的某些化合物发生置换反应
D.X、Y、Z三种元素中,其最高价氧化物对应水化物的酸性强弱顺序是Z>Y>X
在一定温度下可逆反应H2(g)+I2(g)  2HI(g) 达到平衡的标志是
2HI(g) 达到平衡的标志是
| A.有1mol H-H键断裂,同时有2 mol H- I键断裂 |
| B.容器内压强不再随时间而变化 |
| C.单位时间内反应掉n mol I2同时生成2n mol HI |
| D.H2、I2、HI的浓度之比为1∶1∶2 |
下列反应达到平衡后,增大压强或升高温度,平衡都向正反应方向移动的是
A.2NO2 N2O4(正反应为放热反应) N2O4(正反应为放热反应) |
B.H2(g)+I2(g) 2HI(g)(正反应为放热反应) 2HI(g)(正反应为放热反应) |
C.3O2 2O3(正反应为吸热反应) 2O3(正反应为吸热反应) |
D.NH4HCO3(s) NH3+H2O(g)+CO2(正反应为吸热反应) NH3+H2O(g)+CO2(正反应为吸热反应) |
下列有机反应中,不属于取代反应的是
A. |
B.2CH3CH2OH+O2 2CH3CHO+2H2O 2CH3CHO+2H2O |
C.ClCH2CH=CH2+NaOH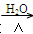 HOCH2CH=CH2+NaCl HOCH2CH=CH2+NaCl |
D. |
下列依据热化学方程式得出的结论正确的是
| A.已知C(石墨, s)=C(金刚石, s); ΔH>0则金刚石比石墨稳定。 |
| B.已知C(s)+O2(g)= CO2(g),ΔH1; C(s)+1/2O2(g)= CO(g),ΔH2;则ΔH1>ΔH2 |
| C.已知2H2(g)+ O2(g)= 2H2O(g);ΔH=" —" 483.6kJ/mol 则氢气的燃烧热为241.8 kJ/mol。 |
| D.已知NaOH(aq)+HCl(aq)=" NaCl(aq)" + H2O(l);ΔH=-57.3kJ/mol 则含20gNaOH的稀溶液与稀盐酸完全中和,放出28.65kJ的热量 |
强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)=H2O(l)△H=-57.3KJ·mol-1。分别向1L 0.5mol·L-1的Ba(OH)2的溶液中加入①浓硫酸;②稀硝酸;③稀醋酸,恰好完全反应的热效应分别为△H1、△H2、△H3,下列关系正确的是 ()
| A.△H1>△H2>△H3 |
| B.△H1>△H2=△H3 |
| C.△H1<△H2<△H3 |
| D.△H1=△H2<△H3 |