下列除去杂质的方法正确的是( )
| A.除去N2中的少量O2:通过灼热的CuO粉末,收集气体 |
| B.除 CO2中的少量HCl:通入饱和Na2CO3溶液,收集气体 |
| C.除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤 |
| D.除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤 |
下列与实验相关的叙述正确的是
| A.红热的铜丝在氯气中燃烧,产生棕黄色的烟雾 |
| B.配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出 |
| C.除去NaHCO3溶液中混有的少量Na2CO3,可采取通入二氧化碳气体的方法 |
| D.检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 |
下列各组离子在指定溶液中能大量共存的是
| A.无色溶液中:K+、Na+、MnO4-、SO42- |
| B.含大量Fe2+溶液中:K+、Cl-、NO3-、Na+ |
| C.加入Al能放出H2的溶液中:Cl-、HCO3-、SO4+、NH4+ |
| D.在酸性溶液中:Ba2+、Na+、SO42-、Cl |
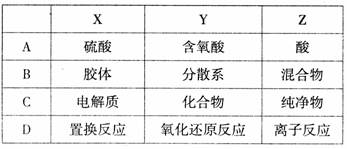
下列各组物质或概念之间,不符合下图所示关系的是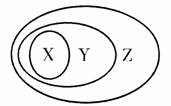
进行化学实验必须注意安全,下列操作不正确的是
| A.做CO还原CuO的实验时,尾气用点燃的方法除去 |
| B.实验室制备并用排水法收集氧气,实验结束时应先撤导管再熄灭酒精灯 |
| C.金属钠、钾起火,可用水、泡沫灭火器等灭火 |
| D.给试管中的液体加热时先预热并不时移动试管或加入碎瓷片,以免爆沸伤人 |
化学已经渗透到人类生活的各个方面,下列说法不正确的是。
| A.明矾能水解生成氢氧化铝胶体,可用作净水剂 |
| B.垃圾是放错地方的资源,应分类回收利用 |
| C.低碳生活注重节能减排,尽量使用太阳能等代替化石燃料,减少温室气体的排放 |
| D.高纯度的硅单质广泛用于制作光导纤维 |