著名化学家徐光宪获得2008年度“国家最高科学技术奖”,以表彰他在稀土串级萃取理论方面作出的贡献。稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是( )
| A.铈的冶炼步骤为:用稀土串级萃法对矿石进行筛选富集;电解熔融CeO2 |
| B.CeO2铈溶于氢碘酸的化学方程式可表示为:CeO2+4HI=CeI4+2 H2O |
| C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+ |
| D.铈能从硫酸铜溶液中置换出铜:Ce+2Cu2+="2Cu+" Ce4+ |
丙烯酸的结构简式为CH2=CH—COOH,其对应的性质中不正确的是()
| A.与钠反应放出氢气 | B.与碳酸氢钠反应 |
| C.能与溴水发生取代反应 | D.发生相互加成反应生成高分子化合物 |
下列物质既能发生消去反应生成相应的烯烃,不能氧化生成相应醛的是 ( )
| A.CH3OH | B.CH3CH2CH2OH | C.CH3CCH2OH | D.CH3CHCH3 |
已知化合物B3N3H6(硼氮苯)与苯的分子结构相似,分别为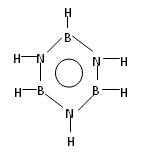

硼氮苯的二氯取代物(B3N3H4Cl2)的同分异构体的数目为( )
| A.2 | B.3 | C.4 | D.5 |
下列有机物命名正确的是 ( )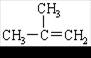
A.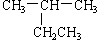 2-乙基丙烷 2-乙基丙烷 |
B.CH3CH2CH2CH2OH 1-丁醇 |
C.CH3- -CH3间二甲苯 -CH3间二甲苯 |
D.2-甲基-2-丙烯 |
下列通式只表示一类物质的是( )
| A.CnH2n+2 | B.CnH2n | C.CnH2n-2 | D.CnH2n-6 |