一定温度下,在氢氧化钡的悬浊液中,存在氢氧化钡固体与其电离的离子间的溶解平衡关系:Ba(OH)2(固体) Ba2++ 2OH-。向此种悬浊液中加入少量的氧化钡粉末,下列叙述正确的是
Ba2++ 2OH-。向此种悬浊液中加入少量的氧化钡粉末,下列叙述正确的是
| A.溶液中钡离子数目减小 | B.溶液中钡离子浓度减小 |
| C.溶液中氢氧根离子浓度增大 | D.pH减小 |
2009年12月16日,国家标准化管理委员会在其官方网站发出《关于电动摩托车相关标准实施事项的通知》。通知要求,《电动摩托车和电动轻便摩托车通用技术条件》等4项国家标准中,涉及电动轻便摩托车内容暂缓实施。这似乎给电动车行业一线生机,电动车电源最常用的是由法国的普朗泰于1860年发明的铅蓄电池,其工作原理为PbO2+2H2SO4+Pb 2PbSO4+2H2O。下列关于铅蓄电池的说法不正确的是( )
2PbSO4+2H2O。下列关于铅蓄电池的说法不正确的是( )
| A.在放电时,该电池的负极材料是铅板 |
| B.在充电时,铅蓄电池的负极与充电器电源的负极相连 |
| C.在放电时,外电路中电流流向为:正极→外电路→负极 |
| D.在充电时,阳极发生的反应为:PbSO4+2e-===Pb+SO |
下列叙述错误的是 ( )
| A.生铁中含有碳,抗腐蚀能力比纯铁弱 | B.用锡焊接的铁质器件,焊接处易生锈 |
| C.在铁制品上镀铜时,铁为阳极,铜盐为电镀液 | D.铁管上镶嵌锌块,铁管不易被腐蚀 |
100 mL浓度为2 mol·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是()
| A.加入适量的6 mol·L-1的盐酸 | B.加入适量蒸馏水 |
| C.加入数滴氯化铜溶液 | D.加入适量的氯化钠溶液 |
下列说法或表示方法正确的是 ( )
| A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
| B.由C(s,石墨)===C(s,金刚石) ΔH=+119 kJ·mol-1可知,金刚石比石墨稳定 |
| C.在稀溶液中:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的稀溶液混合,放出的热量大于57.3 kJ |
| D.在25 ℃、101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)===2H2O(l) ΔH=-285.8 kJ·mol-1 |
某反应的反应过程中能量变化如右图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是 ( )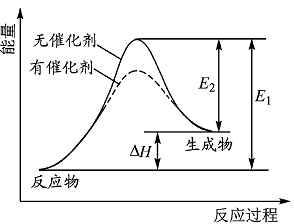
| A.该反应为放热反应 |
| B.催化剂能改变反应的焓变 |
| C.催化剂能降低反应的活化能 |
| D.逆反应的活化能大于正反应的活化能 |