25℃,101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol.下列热化学方程式书写正确的是
| A.2H+(aq)+SO42—(aq)+Ba2+(aq)+2OH-(aq)===BaSO4(s)+2H2O(l);ΔH=-57.3 kJ/mol |
| B.KOH(aq)+1/2H2SO4(aq)===1/2K2SO4(aq)+H2O(l);ΔH=-57.3 kJ/mol |
| C.C8H18(l)+25/2O2(g)===8CO2(g)+9H2O(g);ΔH=-5518 kJ/mol |
| D.2C8H18(g)+25O2(g)===16CO2(g)+18H2O(l);ΔH=-5518 kJ/mol |
相同溶质的两份溶液,一份质量分数为W1,密度为ρ1g·cm-3,浓度为amol·L-1,另一份质量分数为W2,密度为 ρ2g·cm-3,浓度为b mol·L-1,若2a=b,W2<2W1,则ρ1与ρ2的大小关系是
| A.ρ1=ρ2 | B.ρ1<ρ2 | C.ρ1>ρ2 | D.无法比较 |
如图中两条曲线分别表示1g C3H6、1g M气体在相同体积的容器中压强和温度的关系,试根据图判断M气体可能是
| A.C3H4 | B.CO2 | C.CO | D.H2S |
由钠和氧组成的某种离子晶体含钠的质量分数是69/109,其阴离子只有过氧离子(O22-)和氧离子(O2-)两种。在此晶体中,氧离子和过氧离子的物质的量之比为
| A.2∶1 | B.1∶2 | C.1∶1 | D.1∶3 |
能正确表示下列化学反应的离子方程式的是
| A.向碳酸氢铵溶液中加入过量的NaOH固体 NH4++OH-= NH3↑+H2O |
| B.澄清的石灰水与稀盐酸反应 Ca(OH)2 + 2H+ = Ca2+ + 2H2O |
| C.铜片插入硝酸银溶液中 Cu + Ag+ = Cu2+ + Ag |
| D.碳酸钙溶于稀盐酸中 CaCO3+2H+=Ca2++H2O+CO2 |
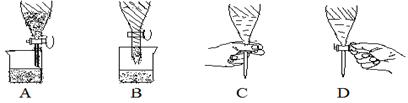
下列各图是分液漏斗使用过程中的操作(其中选项A、B都是两层液体终了关闭活塞时的状态)正确的是( )