A、B、C、D、E五种可溶性化合物,分别由阳离子Fe3+、Ba2+、Al3+、Na+、Ag+和阴离子NO3-、OH-、SO42-、Cl-、CO32-中的各一种组成(离子不重复)。现做如下实验:
①A和E的溶液显碱性,0.1mol·L-1A溶液的pH小于13;
②在B的溶液中逐滴加入氨水有白色沉淀生成,继续加氨水至过量,沉淀消失;
③在C的溶液中加入铁粉,溶液的质量增加;
④在D的溶液中加入过量的Ba(OH)2溶液,没有沉淀。
请回答下列问题:
(1)根据以上事实推断A—E的化学式:
A ;B ;C ;D ;E 。
(2)请用离子方程式表示A溶液显碱性的原因 。
(3)写出③、④的离子方程式:③ ;④ 。
化合物SOCl2是—种液态化合物,沸点为77℃。在盛有10mL水的锥形瓶中,小心地滴加8滴~10滴SOC12,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出。该气体可使滴有品红试液的滤纸褪色。轻轻振荡锥形瓶,等白雾消失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色凝乳状沉淀析出。
(1)根据上述实验,写出SOCl2和水反应的化学方程式:_________________________
(2)AlCl3溶液蒸干灼烧得不到无水AlCl3,而用SOCl2与AlCl3·6H2O混合共热,可得到无水AlCl3,其原因是_________________________________________________。
相同条件下pH=3的盐酸和pH=3的醋酸:
(1)取等体积两溶液,分别稀释pH=4时,两者加水量的关系是:前者________后者(填>、<或=,下同);
(2)取等体积的两溶液,分别加入等物质的量的相应钠盐固体少量,两溶液的pH大小关系是:前者_________后者;
(3)各取两溶液VL,分别加入VLpH=11的NaOH,充分反应后,两溶液pH大小关系是:前者__________后者。
电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: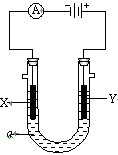
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
① 电解池中X极上的电极反应式为。在X极附近观察到的现象是。
② Y电极上的电极反应式为,检验该电极反应产物的方法是。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
① X电极的材料是,电极反应式是。
② Y电极的材料是,电极反应式是。
(7分)已知A、B、C为中学化学中常见的单质。室温下,A为固体,B和C均为气体。在适宜的条件下,它们可以按右面框图进行反应。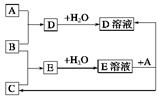
回答下列问题:
(1)A、B、C三种元素中的任意两种元素形成的化合物所属物质类别一定不是 _。
①氢化物 ②酸 ③碱 ④盐 ⑤氧化物
(2)A、B、C三种元素中有一种是金属,则这种元素是A、B、C中的,理由是。
(3)如果E溶液是一种强酸,则E的化学式为 。
(10分) 中国古代四大发明之一——黑火药,它的爆炸反应为:
2KNO3+3C+SA+N2↑+3CO2↑(已配平)
(1)①除S外,上列元素的电负性从大到小依次为______________________。
②在生成物中,A的晶体类型为___,含极性共价键的分子的中心原子轨道杂化类型为____。
③已知CN-与N2为等电子体,推算HCN分子中σ键与π键数目之比为________________。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为______,Q2+的未成对电子数是_______。
(3)若某金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为,该单质晶体中原子的堆积方式为四种基本堆积方式中的.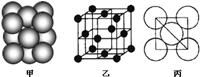
(4)在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R—H),可发生离子交换反应:[CrCln(H2O)6-n]x++xR—H―→Rx[CrCln(H2O)6-n]x++xH+交换出来的H+经中和滴定,即可求出x和n,确定配离子的组成。将含0.0015 mol [CrCln(H2O)6-n]x+的溶液,与R—H完全交换后,中和生成的H+需浓度为0.1200mol·L-1NaOH溶液25.00 mL,可知该配离子的化学式为______,中心离子的配位数为。