甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H1 =" +" 49.0 kJ·mol -1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) △H2 =-192.9 kJ·mol -1
下列说法错误的是( )
| A.H2燃烧能放出大量的热,故CH3OH转变成H2的过程必须吸收能量 |
| B.反应②中的能量变化如右图所示,则△H2= E1- E2 |
| C.根据②推知,CH3OH的燃烧热△H<-192.9 kJ·mol -1 |
| D.在下图中,加入合适的催化剂,可使E3降低 |

将0.5molPCl5充入体积为1L的密闭容器中,发生反应PCl5 PCl3+Cl2,一段时间后测得PCl5的浓度为0.3mol/L,且这段时间内的平均反应速率υ(PCl5)= 0.4 mol/(L·min),则这段时间为( )
PCl3+Cl2,一段时间后测得PCl5的浓度为0.3mol/L,且这段时间内的平均反应速率υ(PCl5)= 0.4 mol/(L·min),则这段时间为( )
A.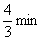 |
B. |
C.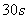 |
D.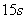 |
把镁条投入到盛有盐酸的敞口容器里,产生H2的速率如图所示,在下列因素中,影响O~t1时间段反应速率的主要因素是( )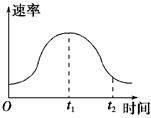
| A.盐酸的浓度 | B.镁条的表面积 | C.Cl-的浓度 | D.溶液的温度 |
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是( )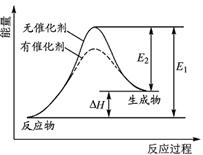
| A.该反应为放热反应 | B.催化剂能改变反应的焓变 |
| C.催化剂能降低反应的活化能 | D.逆反应的活化能大于正反应的活化能 |
自然界的矿物、岩石的成因和变化受到许多条件的影响。地壳内每加深1km,压强增大约25000~30000 kPa。在地壳内SiO2和HF存在以下平衡:SiO2 (s) + 4HF(g)  SiF4 (g) + 2H2O(g),若该反应在恒温恒容的密闭容器中发生,不能判断反应已经达到化学平衡的是()
SiF4 (g) + 2H2O(g),若该反应在恒温恒容的密闭容器中发生,不能判断反应已经达到化学平衡的是()
| A.v正(HF)= 2v逆(H2O) | B.混合气体的密度保持不变 |
| C.SiO2的质量保持不变 | D.反应物不再转化为生成物 |
如图装置(Ⅰ)为一种可充电电池的示意图,其中的离子交换膜只允许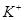 通过,该电池放电时的化学方程式为:
通过,该电池放电时的化学方程式为: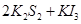 =
=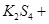 3KI。装置(Ⅱ)为电解示意图,当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法正确的是( )
3KI。装置(Ⅱ)为电解示意图,当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法正确的是( ) 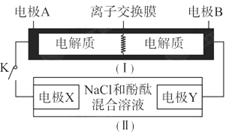
A.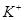 从右到左通过离子交换膜 从右到左通过离子交换膜 |
B.电极A上发生的反应为: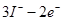 = =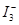 |
C.电极X上发生的反应为: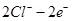 = =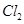 ↑ ↑ |
D.当有0.1 mol 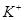 通过离子交换膜,X电极上产生1.12 L气体(标准状况) 通过离子交换膜,X电极上产生1.12 L气体(标准状况) |