理论上不能设计为原电池的化学反应是( )
A.CH4(g)+2O2(g) CO2(g)+2H2O(1);△H<0 CO2(g)+2H2O(1);△H<0 |
B.HNO3(1)+NaOH(1) NaNO3(1)+H2O(1);△H<0 NaNO3(1)+H2O(1);△H<0 |
C.2H2(g)+O2(g) 2H2O(1);△H<0 2H2O(1);△H<0 |
| D.2FeCl3(1)+Fe(s)==3FeCl2(1);△H<0 |
(2014届上海市十三校高三测试)下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。下列说法正确的是()
| A.该图体现出原子核外电子层呈现周期性变化 |
| B.原子半径:W>R>X |
| C.W的氢化物与R的氢化物水溶液的酸性比较,前者强于后者,可证明非金属性:R>W |
| D.R、Z形成的化合物中可能含有共价键 |
短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同。X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,而Z不能形成双原子分子。根据以上叙述,下列说法中正确的是( )
| A.上述四种元素的原子半径大小为W<X<Y<Z |
| B.W、X、Y、Z原子的核外最外层电子数的总和为20 |
| C.W与Y可形成既含极性共价键又含非极性共价键的化合物 |
| D.由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |
如图是元素周期表的一部分,下列关系正确的是
A.原子半径: |
B.热稳定性: |
C.还原性: |
D.酸性: |
原子结构决定元素的性质,下列说法中,正确的是
| A.Na、Al、Cl的原子半径依次减小,Na+、Al3+、Cl-的离子半径也依次减小 |
| B.在第ⅥA族元素的氢化物(H2R)中,热稳定性最强的其沸点也一定最高 |
| C.第2周期元素的最高正化合价都等于其原子的最外层电子数 |
| D.非金属元素的非金属性越强,其氧化物对应水化物的酸性也一定越强 |
(2014届广东省梅州市高三3月总复习质检)
短周期金属元素甲~丁在元素周期表中的相对位置如表所示: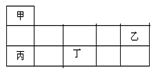
下列判断正确的是( )
| A.原子半径:丙>丁>乙 |
| B.单质的还原性:丁>丙>甲 |
| C.甲、乙、丙的氧化物均为共价化合物 |
| D.乙、丙、丁的最高价氧化物对应的水化物能相互反应 |