为了防止轮船船体的腐蚀,应在船壳水线以下位置嵌下一定数量的( )
| A.铜块 | B.铅块 | C.锌块 | D.钠块 |
下列无色溶液中的离子能大量共存的是
| A.K+、Na+、MnO4-、SO42- | B.H+、K+、NO3-、SO32- |
| C.Na+、Ba2+、Cl-、Br- | D.Fe3+、NH4+、SCN-、HCO3- |
下列有关物质的性质的应用不正确的是
| A.甲醛能使蛋白质变性,常用高浓度甲醛溶液浸泡食用海产品以防腐 |
| B.硅胶多孔、吸水能力强,常用作袋装食品的干燥剂 |
| C.过氧化钠能与二氧化碳反应产生氧气,可用作潜水艇的供养剂 |
| D.锌的金属活泼型比铁强,可用于保护石油管道(碳素钢管)以减缓其腐蚀 |
下列有关化学用语正确的是
| A.明矾的化学式:KAl(SO4)2 |
B.氯离子的结构示意图: |
| C.2-丙醇的结构简式:(CH3)2CHOH |
D.溴化铵的电子式: |
下列关于有机物的说法中,正确的是
| A.乙烯、苯、乙醇均能使酸性高锰酸钾溶液褪色 |
| B.乙烯和聚丙烯都能与氢气在一定条件下发生加成反应 |
| C.煤制煤气是化学变化,是高效、清洁地利用煤的重要途径 |
| D.乙酸乙酯、油脂、葡萄糖、蛋白质都可以发生水解反应 |
手性分子是指在分子结构 中,当a、b、x、y为彼此互不相同的原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子。下列分子中指定的碳原子(用*标记)不属于手性碳原子的是
中,当a、b、x、y为彼此互不相同的原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子。下列分子中指定的碳原子(用*标记)不属于手性碳原子的是
A.苹果酸 |
B.丙氨酸 |
C.葡萄糖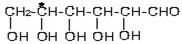 |
D.甘油醛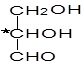 |