取相同体积的KI、Na2S、FeBr2溶液,分别通入足量的Cl2,当反应恰好完成时,消耗Cl2的体积相同(同温、同压条件下),则KI、Na2S、FeBr2溶液的物质的量浓度之比是( )
| A.1∶1∶2 | B.2∶1∶3 | C.6∶3∶2 | D.3∶2∶1 |
利用下列实验装置能完成相应实验的是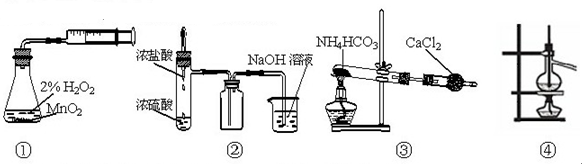
| A.装置①测定化学反应速率 | B.装置②制取并吸收HCl |
| C.装置③制备纯净的NH3 | D.装置④可用于分离沸点相差较大的互溶液体混合物 |
a、b、c三种短周期元素在元素周期表中的相对位置如图所示,a与b的质子数之和比c的质子数少1,以下说法错误的是
| A.a与c均存在同素异形体 |
| B.原子半径由大到小的顺序为:c > a > b |
| C.b的氢化物的稳定性小于 c的氢化物的稳定性 |
| D.c的单质可用于制造太阳能电池 |
化学与环境保护、工业生产、生活等密切相关。下列说法不正确的是
| A.工业上,用焦炭在电炉中还原二氧化硅得到含杂质的粗硅 |
| B.大力实施矿物燃料“脱硫、脱硝技术”,减少硫的氧化物和氮的氧化物污染 |
| C.棉花和木材的主要成分都是纤维素,蚕丝和人造丝的主要成分都是蛋白质 |
| D.硫酸和硝酸是重要的工业原料,工业上可用于制化肥、农药和炸药 |
用下图表示的一些物质或概念间的从属关系中,正确的是:
下列各反应的离子方程式书写中,正确的是
| A.金属钠投入水中:Na + 2H2O = Na+ + OH-+ H2↑ |
| B.用FeCl3溶液腐蚀铜线路板:Cu + Fe3+= Cu2+ + Fe2+ |
| C.向Na2CO3溶液中加入过量CH3COOH溶液: CO32-+ 2H+= CO2↑ + H2O |
| D.漂白粉溶液中通入过量的二氧化碳: ClO-+ CO2 + H2O = HCO3-+ HClO |