现有下列四个小实验,简要实验步骤及现象如下
①在紫色的KMnO4酸性稀溶液中,逐滴滴入过氧化氢溶液,溶液温度变化不大,但褪色速率越来越快
②将化学荧光棒[外层是塑料管放草酸二苯酯(还原剂)及发光颜料,内玻璃管中放入4%过氧化氢溶液]弯曲,内管断裂,液体混合,发出五颜六色的光。
③两根外形相同的铁棒和锡棒紧靠,放入稀硫酸中,发现一根棒的表面有气泡产生
④正在烧煤球的煤炉中,滴上几滴水,立刻串出火苗
下列分析正确的是( )
| A.实验①中,反应生成的Mn2+可能是该反应的催化剂 |
| B.实验②中,该反应是太阳能转变为光能 |
| C.实验③中,有气泡产生的棒是铁棒 |
| D.实验④中,加入的水是反应的催化剂,且该反应能自发进行 |
海水资源的综合利用十分重要,不需要通过化学变化就能够从海水中获得的物质是
| A.食盐 | B.钠 | C.溴 | D.碘 |
下列有关环境保护与绿色化学的叙述不正确的是
| A.形成酸雨的主要物质是硫的氧化物和氮的氧化物 |
| B.大气污染物主要来自化石燃料燃烧和工业生产过程产生的废气 |
| C.绿色化学的核心就是如何对被污染的环境进行无毒无害的治理 |
| D.水华、赤潮等水体污染主要是由含氮、磷的污水任意排放造成的 |
部分氧化的铁铜合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理: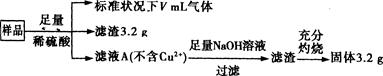
下列说法正确的是()
| A.滤液A中的阳离子为Fe3+、Fe2+、H+ |
| B.V=896 |
| C.样品中CuO的质量为4.0 g |
| D.样品中Fe元素的质量为2.24g |
下列说法不正确的是()
A.燃烧等质量的烃,耗氧量最多的一定是甲烷
B.25 mL 三种气态混合烃在足量氧气中充分燃烧后, 恢复到原常温常压下, 体积共缩小50 mL, 则三种烃可能是质量比为11:14:26的C3H8、C4H8、C2H2
C.A、B两种有机物组成混合物,当混合物质量一定时,无论A、B以何种比例混合,完全燃烧产生CO2的量均相等,符合这一组合条件的A、B两物质可能互为同系物或同分异构体或最简式相同
D.等物质的量的烃或烃的含氧衍生物A和B完全燃烧时,消耗氧气的量相等,则A和B的相对分子质量相差只可能为18n 、44n (n为正整数)
下列实验中,所选装置不合理的是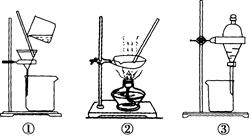
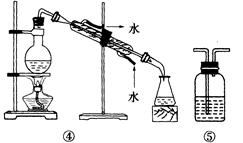
| A.粗盐提纯,选①和② |
| B.用CCl4提取碘水中的碘,选③ |
| C.分离Na2CO3溶液和CH3COOC2H5,选④ |
| D.用NaOH溶液吸收Cl2,选⑤ |