一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO): CO(g)+2H2(g) CH3OH(g),甲醇生成量与时间的关系如图所示。下列有关说法正确的是.
CH3OH(g),甲醇生成量与时间的关系如图所示。下列有关说法正确的是.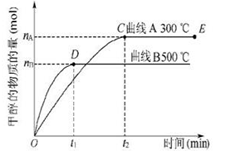
| A.在300 ℃条件下,t1时刻该反应达到化学平衡 |
| B.在500 ℃条件下,从反应开始到平衡,氢气的平均反应速率v(H2)为nB/(3t1) mol/L |
| C.在其他条件不变的情况下,将处于E点的体系体积压缩到原来的1/2,则氢气的浓度减小 |
| D.由图像说明该反应的正反应为放热反应 |
20 ℃时H2S饱和溶液1 L,其浓度为0.1 mol·L-1,已知其电离方程式为H2S H++HS-,HS-
H++HS-,HS- H++S2-,若要使该溶液H+及S2-浓度都减小,可采取的措施是
H++S2-,若要使该溶液H+及S2-浓度都减小,可采取的措施是
| A.通入适量的HCl | B.加入适量的NaOH固体 |
| C.通入适量的SO2 | D.加入适量的CuSO4固体 |
水是一种极弱的电解质,在室温下,KW=1×10-14,则此时水的电离百分数为:
| A.1×10-7 | B.1/55.6 | C.10-14 | D.1/(55.6×107) |
某pH=1的ZnCl2和HCl的混合溶液中含有FeCl3杂质,通过水解除去杂质,需将溶液调至pH=4,在调节溶液pH时,应选用的试剂是
| A.NaOH | B.ZnO | C.Na2CO3 | D.Fe2O3 |
在密闭容器中充入4 mol SO2和3 mol O2,一定条件下建立如下平衡:2SO2(g)+O2(g) 2SO3(g) ΔH=-Q kJ/mol,测得SO2的转化率为90%,则在此条件下反应放出的热量为
2SO3(g) ΔH=-Q kJ/mol,测得SO2的转化率为90%,则在此条件下反应放出的热量为
| A.2Q kJ | B.Q kJ | C.1.8Q kJ | D.0.9Q kJ |
0.1 mol/L K2CO3溶液中,若要使c(CO32-)更接近0.1 mol/L,可采取的措施是
| A.加入少量盐酸 | B.加KOH固体 | C.加水 | D.加热 |