用NA表示阿伏加德罗常数的数值,下列说法错误的是( )
| A.1mol H2和O2的混合气体在标准状况下的体积约为22.4L |
| B.20℃、101kPa下,16g氧气中所含的氧原子数为NA |
| C.18g水所含的电子数为8NA |
| D.在标准状况下,0.5NA个氯气分子所占体积约是11.2L |
下列物质中属于非电解质的是( )
| A.氯化氢 | B.氯水 | C.铜 | D.二氧化碳 |
最近,中国科大的科学家们将C60分子组装在一单层分子膜表面,在—268℃时冻结分子的热振荡,并利用扫描隧道显微镜首次“拍摄”到能清楚分辨碳原子间单、双键的分子图像。下列化合物分子中一定既含单键又含双键的是()
| A.CO2 | B.C2H4O | C.COCl2 | D.H2O2 |
2008年的秋天,毒奶粉事件震惊全国,这主要是奶粉中含有有毒的三聚氰胺(分子结构如下图所示)。下列关于三聚氰胺分子的说法中正确的是()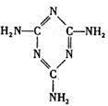
| A.三聚氰胺的分子式为C3N3H6 |
| B.所有碳原子都采用sp2杂化 |
| C.属于极性分子,故极易溶于冷水 |
| D.形成的晶体熔点较高 |
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是()
| A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 |
| B.沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4] 2+ |
| C.向反应后的溶液加入乙醇,溶液将会没有发生变化,因为[Cu(NH3)4] 2+不会与乙醇反应 |
| D.在[Cu(NH3)4] 2+离子中,Cu2+给出孤对电子,NH3提供空轨道 |
对于SO2和CO2说法正确的是( )
A.都是直线形结构  |
B.中心原子都采用SP杂化轨道 |
| C.S原子和C原子上都没有孤对电子 | D.SO2为V形结构,CO2为直线形结构 |