将质量分数为a%,物质的量浓度为c1 mol·L-1的稀H2SO4蒸发掉一定量的水,使之质量分数为2a%,此时物质的量浓度为c2 mol·L-1,则c1和c2的数值关系是( )C
| A.c2=2c1 | B.c2<c1 | C.c2>2c1 | D.无法确定 |
用NA表示阿伏加德罗常数的数值,下列说法正确的是 ( )
| A.11.2L O2所含的分子数目为0.5 NA |
| B.44g CO2所含的原子数目为NA |
| C.1L 1.00mol·L-1Na2CO3溶液中Na+离子数目为2NA |
| D.1mol Fe与足量盐酸完全反应,Fe失去的电子数目为3NA |
下列关于氯化铁溶液和氢氧化铁胶体的说法中,正确的是()
| A.两种分散系均呈红褐色 | B.分散质的粒子都可以透过半透膜 |
| C.分散质的粒子直径均在1-100nm之间 | D.可用丁达尔效应加以鉴别 |
同物质的量的SO2和SO3,下列说法正确的是()
| A.硫元素的质量之比为5︰4 | B.分子数之比为1︰1 |
| C.原子总数之比为4︰3 | D.质量之比为1︰1 |
下列状态的物质,既属于电解质又能导电的是()
A、酒精 B、氯化钾晶体 C、液态的氯气 D 熔融的氢氧化钠
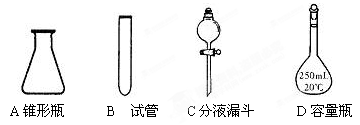
实验室中配制250mL 0.10mo1·L-1NaOH溶液时,必须使用到的玻璃仪器是()