某探究小组利用丙酮的溴代反应(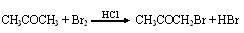 )来研究反应物浓度与反应速率的关系。反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
)来研究反应物浓度与反应速率的关系。反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
| 实验 序号 |
初始浓度c/mol·l-1 |
溴颜色消失所需时间t/s |
||
| CH3COCH3 |
HCl |
Br2 |
||
| ① |
0.80 |
0.20 |
0.0010 |
290 |
| ② |
1.60 |
0.20 |
0.0010 |
145 |
| ③ |
0.80 |
0.40 |
0.0010 |
145 |
| ④ |
0.80 |
0.20 |
0.0020 |
580 |
分析实验数据所得出的结论不正确的是( )
A.增大c(CH3COCH3),υ(Br2)增大 B.实验②和③的υ(Br2)相等
C.增大c(HCl),υ(Br2)增大 D.增大c(Br2),υ(Br2)增大
中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论合理的是()
| A.根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 |
| B.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 |
| C.根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
| D.根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性 |
下列不能形成配位键的组合是( )
| A.Ag+、NH3 | B.BF3、NH3 | C.Co3+、CO | D.Ag+、H+ |
下列物质不能溶于浓氨水的是
| A.AgCl | B.Cu(OH)2 | C.AgOH | D.Fe(OH)3 |
下列分子或离子中,含有孤对电子的是()
| A.H2O | B.CH4 | C.SiH4 | D.NH4+ |
下列表示式错误的是( )
A.Na+的电子排布图: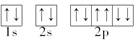 |
B.Na+的结构示意图: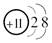 |
| C.Na的电子排布式:1s22s22p63s1 |
| D.Na的简化电子排布式:[Ne]3s1 |