(12分)写出下列反应的热化学方程式。
(1)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) ΔH=+64.39kJ/mol
2H2O2(l)=2H2O(l)+O2(g) ΔH=-196.46kJ/mol
H2(g)+1/2 O2(g)=H2O(l) ΔH=-285.84kJ/mol
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 。
(2)在298K下,C、Al的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,Al能将C从CO2置换出来,写出此置换反应的热化学方程式
(3)25℃,1.01×105Pa下,1g 硫粉在氧气中充分燃烧放出 9.36kJ热量,写出表示硫燃烧热的热化学方程式
80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4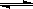 2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) n(mol) |
0 |
20 |
40 |
60 |
80 |
100 |
| n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
| n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
①计算20s—40s内用N2O4表示的平均反应速率为
②计算在80℃时该反应的平衡常数K=;
③反应进行至l00s后将反应混合物的温度降低,混合气体的颜色(填“变浅”、“变深”或“不变”);
④要增大该反应的K值,可采取的措施有(填序号);
A.增大N2O4的起始浓度 B.向混合气体中通入NO2 C.使用高效催化剂 D.升高温度
(1)现有①苛性钠②碳酸钙固体③酒精④硫化氢⑤三氧化硫⑥金属镁⑦石墨⑧NH3·H2O,其中(填序号)属于强电解质的是,属于弱电解质的是,属于非电解质的是,既不是电解质,又不是非电解质的是。
(2)用pH试纸测定溶液的pH,正确操作是。
用Na2CO3固体配制1mol/L的Na2CO3溶液100mL。
(1)供选用的仪器有:①玻璃棒;②胶头滴管;③酒精灯;④100mL容量瓶;⑤250mL量筒;⑥天平;⑦50mL烧杯;应选用的仪器(填编号)。
(2)应称取Na2CO3的质量为g;若称量时砝码和物品放反了,则实际称量的Na2CO3的质量为g 。
(3)下列操作,会引起所配溶液浓度偏高的是()
| A.称取的Na2CO3固体中有杂质 |
| B.溶解Na2CO3固体时,因搅拌剧烈使烧杯中的溶液溅出少量 |
| C.没有洗涤烧杯及玻璃棒 |
| D.定容时发现液面高于刻度线,用胶头滴管吸出多余的溶剂 |
E、定容时仰视刻度线
F、定容时俯视刻度线
G、定容摇匀后,发现液面低于刻度线,再加至刻度线
(4)取所配Na2CO3溶液20ml,向其中滴加足量的稀盐酸,可得到标况下的气体L,将得到的气体全部通入足量的澄清石灰水,充分反应后,将沉淀过滤,洗涤,干燥,最后可得固体g。
(12分)现有失去标签的CaCl2、AgNO3、HCl、和Na2CO3四瓶溶液。为了确定四种溶液的成分,将它们编号为A、B、C、D后进行化学实验。实验记录如下:
| 实验顺序 |
实验内容 |
实验现象 |
| ① |
A + B |
无明显现象 |
| ② |
B + D |
有无色无味气体放出 |
| ③ |
C + B |
有白色沉淀生成 |
| ④ |
A + D |
有白色沉淀生成 |
根据上述实验完成下列各小题:
(1)A、B、C、D四瓶溶液分别是(用化学式表示所含溶质)
ABCD
(2)写出B与D反应的离子方程式
写出B与C反应的离子方程式
按要求完成下列各题。
(1)向澄清石灰水中通入CO2(写出离子方程式)
(2)用稀硫酸洗铁锈(Fe2O3)(写出离子方程式)
(3)2Al + 6H+ ="=" 2Al3+ + 3H2↑(写出对应的化学方程式并用双线桥法标出电子转移情况)